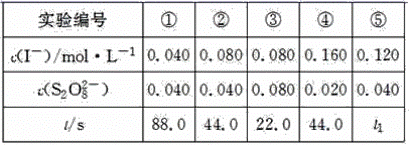
在相同条件下研究催化剂 I 、 Ⅱ 对反应 的影响,各物质浓度 c 随反应时间 t 的部分变化曲线如图,则
A .无催化剂时,反应不能进行
B .与催化剂 Ⅰ 相比, Ⅱ 使反应活化能更低
C . a 曲线表示使用催化剂 Ⅱ 时 X 的浓度随 t 的变化
D .使用催化剂 Ⅰ 时, 内,
答案
D
【详解】 A .由图可知,无催化剂时,随反应进行,生成物浓度也在增加,说明反应也在进行,故 A 错误;
B .由图可知,催化剂 I 比催化剂 Ⅱ 催化效果好,说明催化剂 I 使反应活化能更低,反应更快,故 B 错误;
C .由图可知,使用催化剂 Ⅱ 时,在 0~2min 内 Y 的浓度变化了 2.0mol/L ,而 a 曲线表示的 X 的浓度变化了 2.0mol/L ,二者变化量之比不等于化学计量数之比,所以 a 曲线不表示使用催化剂 Ⅱ 时 X 浓度随时间 t 的变化,故 C 错误;
D .使用催化剂 I 时,在 0~2min 内, Y 的浓度变化了 4.0mol/L ,则 (Y) =
=
=2.0
,
(X) =
(Y) =
2.0
=1.0
,故 D 正确;
答案选 D 。