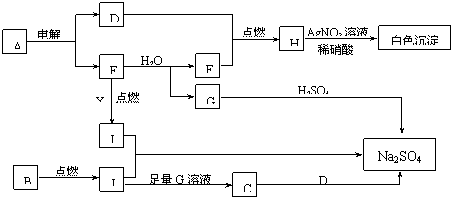
若将铜丝插入热浓硫酸中进行如图 (a~d 均为浸有相应试液的棉花 ) 所示的探究实验,下列分析正确的是
A . 与浓硫酸反应,只体现
的酸性
B . a 处变红,说明 是酸性氧化物
C . b 或 c 处褪色,均说明 具有漂白性
D .试管底部出现白色固体,说明反应中无 生成
答案
B
【详解】 A .铜和浓硫酸反应过程中,生成 CuSO 4 体现出浓硫酸的酸性,生成 SO 2 体现出浓硫酸的强氧化性,故 A 错误;
B . a 处的紫色石蕊溶液变红,其原因是 SO 2 溶于水生成了酸,可说明 SO 2 是酸性氧化物,故 B 正确;
C . b 处品红溶液褪色,其原因是 SO 2 具有漂白性,而 c 处酸性高锰酸钾溶液褪色,其原因是 SO 2 和 KMnO 4 发生氧化还原反应, SO 2 体现出还原性,故 C 错误;
D .实验过程中试管底部出现白色固体,根据元素守恒可知,其成分为无水 CuSO 4 ,而非蓝色的 CuSO 4 ·5H 2 O ,其原因是浓硫酸体现出吸水性,将反应生成的 H 2 O 吸收,故 D 错误;
综上所述,正确的是 B 项。


 2SO3
2SO3





 无色溶液
无色溶液 恢复原色。
恢复原色。


 ,如下数轴所示:
,如下数轴所示:
 则固体物质为Na2SO3,
则固体物质为Na2SO3, ,则固体物质为NaOH 和Na2SO3.
,则固体物质为NaOH 和Na2SO3. ,则同体物质为NaHSO3
,则同体物质为NaHSO3 ,则固体物质为Na2SO3和NaHSO3,
,则固体物质为Na2SO3和NaHSO3, ,则固体物质为NaHSO3。
,则固体物质为NaHSO3。