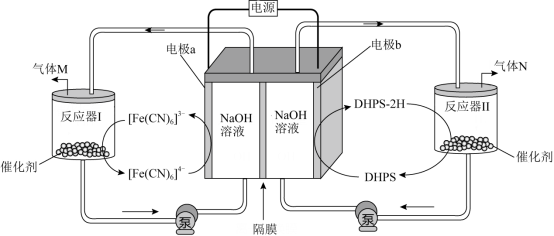
科学家研制了一种能在较低电压下获得氧气和氢气的电化学装置,工作原理示意图如图。
下列说法正确的是
A .电极 b 为阳极
B .隔膜为阴离子交换膜
C .生成气体 M 与 N 的物质的量之比为 2 : 1
D .反应器 I 中反应的离子方程式为 4[Fe(CN) 6 ] 3— +4OH — 4[Fe(CN) 6 ] 4— +O 2 ↑+2H 2 O
答案
BD
【分析】由图可知, a 电极为阳极,碱性条件下 [Fe(CN) 6 ] 4— 离子在阳极失去电子发生氧化反应生成 [Fe(CN) 6 ] 3— 离子,催化剂作用下, [Fe(CN) 6 ] 3— 离子与氢氧根离子反应生成 [Fe(CN) 6 ] 4— 离子、氧气和水, b 电极为阴极,水分子作用下 DHPS 在阴极得到电子发生还原反应生成 DHPS—2H 和氢氧根离子,催化剂作用下, DHPS—2H 与水反应生成 DHPS 和氢气,氢氧根离子通过阴离子交换膜由阴极室向阳极室移动,则 M 为氧气、 N 为氢气。
【详解】 A .由分析可知, b 电极为电解池的阴极,故 A 错误;
B .由分析可知,氢氧根离子通过阴离子交换膜由阴极室向阳极室移动,则隔膜为阴离子交换膜,故 B 正确;
C .由分析可知, M 为氧气、 N 为氢气,由得失电子数目守恒可知,氧气和氢气的的物质的量之比为 1 : 2 ,故 C 错误;
D .由分析可知,反应器 I 中发生的反应为催化剂作用下, [Fe(CN) 6 ] 3— 离子与氢氧根离子反应生成 [Fe(CN) 6 ] 4— 离子、氧气和水,反应的离子方程式为 4[Fe(CN) 6 ] 3— +4OH — 4[Fe(CN) 6 ] 4— +O 2 ↑+2H 2 O ,故 D 正确;
故选 BD 。



