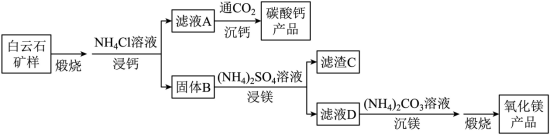
白云石的主要化学成分为 ,还含有质量分数约为 2.1% 的 Fe 2 O 3 和 1.0% 的 SiO 2 。利用白云石制备高纯度的碳酸钙和氧化镁,流程示意图如下。
已知:
| 物质 | | | | |
| | | | | |
(1) 白云石矿样煅烧完全分解的化学方程式为 。
(2) 用量对碳酸钙产品的影响如下表所示。
| | 氧化物 ( | 产品中 | 产品中 Mg 杂质含量 /% ( 以 | ||
| | | 计算值 | 实测值 | ||
| 2.1∶1 | 98.4 | 1.1 | 99.1 | 99.7 | —— |
| 2.2∶1 | 98.8 | 1.5 | 98.7 | 99.5 | 0.06 |
| 2.4∶1 | 99.1 | 6.0 | 95.2 | 97.6 | 2.20 |
备注: ⅰ 、 浸出率 =( 浸出的
质量 / 煅烧得到的
质量 )
(M 代表 Ca 或 Mg)
ⅱ 、 纯度计算值为滤液 A 中钙、镁全部以碳酸盐形式沉淀时计算出的产品中
纯度。
① 解释 “ 浸钙 ” 过程中主要浸出 的原因是 。
② 沉钙反应的离子方程式为 。
③“ 浸钙 ” 过程不适宜选用 的比例为 。
④ 产品中 纯度的实测值高于计算值的原因是 。
(3)“ 浸镁 ” 过程中,取固体 B 与一定浓度的 溶液混合,充分反应后
的浸出率低于 60% 。加热蒸馏,
的浸出率随馏出液体积增大而增大,最终可达 98.9% 。从化学平衡的角度解释浸出率增大的原因是 。
(4) 滤渣 C 中含有的物质是 。
(5) 该流程中可循环利用的物质是 。
答案
(1)
(2) ,在一定量
溶液中,氢氧化钙会和氯化铵反应而氢氧化镁不能,故
先浸出
2.4∶1
,
优先析出,且氧化钙也能转化为碳酸钙
(3) ,
,随大量氨逸出,平衡正向移动
(4)
(5)
【分析】白云石矿样煅烧后 转化为氧化钙、氧化镁,加入氯化铵溶解浸钙,大部分钙离子进入滤液 A ,通入二氧化碳生成碳酸钙;过滤分离出含有镁、铁、硅元素的固体 B ,加入硫酸铵将镁离子转化为硫酸镁溶液,加入碳酸铵生成碳酸镁沉淀,煅烧得到氧化镁;
【详解】( 1 )白云石矿样煅烧完全分解生成氧化钙、氧化镁、二氧化碳气体,化学方程式为 ;
( 2 ) ① 氯化铵水解生成一水合氨与氢离子,可以调节溶液的 pH ,由图表可知, ,在一定量
溶液中,氢氧化钙会和氯化铵反应而氢氧化镁不能,故
首先溶解被浸出;
② 沉钙反应中通入二氧化碳和滤液中钙离子、氨气反应生成碳酸钙沉淀和铵根离子,离子方程式为 。
③ 由图表可知, “ 浸钙 ” 过程 的比例为 2.4∶1 时,产品中镁元素杂质最多且碳酸钙纯度最低,故不适宜选用
的比例为 2.4∶1 。
④ ,在反应中
会优先析出,但也有可能析出其他沉淀,且 Mg 2+ 部分以 Mg(OH) 2 形成沉淀,相比 MgCO 3 质量更小,二者共同作用导致产品中
纯度的实测值高于计算值;
( 3 ) “ 浸镁 ” 过程中,发生反应: ,
,加热蒸馏随大量氨逸出,平衡正向移动,利于氢氧化镁转化为硫酸镁;
( 4 )白云石的主要化学成分为 ,还含有质量分数约为 2.1% 的 Fe 2 O 3 和 1.0% 的 SiO 2 ;煅烧浸钙后,绝大部分钙进入滤液中,部分钙进入 B 中加入硫酸铵后转化为微溶于的硫酸钙,氧化铁、二氧化硅几乎不反应进入滤渣中; “ 浸镁 ” 过程中,
的浸出率最终可达 98.9% ,则还有部分氧化镁进入滤渣中,故滤渣 C 中含有的物质是
;
( 5 )沉钙反应中通入二氧化碳生成碳酸钙和氯化铵; “ 浸镁 ” 过程中加热蒸馏会有大量氨逸出;滤液 D 加入碳酸铵生成碳酸镁和硫酸铵,碳酸镁煅烧生成二氧化碳;白云石煅烧也会生成二氧化碳;在流程中 既是反应物又是生成物,故该流程中可循环利用的物质是
。
