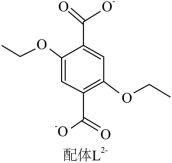
配位化合物 X 由配体 L 2- ( 如图 ) 和具有正四面体结构的 [Zn 4 O] 6+ 构成。
(1) 基态 Zn 2+ 的电子排布式为 。
(2)L 2- 所含元素中,电负性最大的原子处于基态时电子占据最高能级的电子云轮廓图为 形;每个 L 2- 中采取 sp 2 杂化的 C 原子数目为 个, C 与 O 之间形成 σ 键的数目为 个。
(3)X 晶体内部空腔可吸附小分子,要增强 X 与 H 2 O 的吸附作用,可在 L 2- 上引入 。 ( 假设 X 晶胞形状不变 ) 。
A .- Cl B .- OH C .- NH 2 D .- CH 3
(4)X 晶体具有面心立方结构,其晶胞由 8 个结构相似的组成单元 ( 如图 ) 构成。
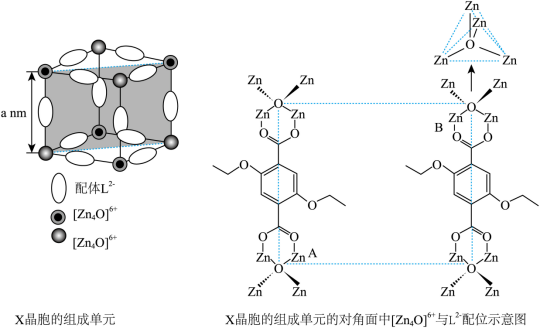
① 晶胞中与同一配体相连的两个 [Zn 4 O] 6+ 的不同之处在于 。
②X 晶体中 Zn 2+ 的配位数为 。
③ 已知 ZnO 键长为 dnm ,理论上图中 A 、 B 两个 Zn 2+ 之间的最短距离的计算式为 nm 。
④ 已知晶胞参数为 2anm ,阿伏加德罗常数的值为 N A , L 2- 与 [Zn 4 O] 6+ 的相对分子质量分别为 M 1 和 M 2 ,则 X 的晶体密度为 g•cm -3 ( 列出化简的计算式 ) 。
答案
(1)3d 10
(2) 哑铃形 8 8
(3)BC
(4) 与 Zn 2+ 相连的双键氧原子不在对称轴的同侧 4 a—2d
【详解】( 1 )锌元素的原子序数为 30 ,基态锌离子的价电子排布式为 3d 10 ,故答案为: 3d 10 ;
( 2 )配体 L 2- 所含元素中氧元素的电负性最大,氧原子处于基态时,电子云轮廓图为哑铃形的 2p 能级的电子占据最高能级;由结构简式可知,配体中苯环碳原子和双键碳原子杂化方式为 sp 2 杂化,共有 8 个;配体中碳原子与氧原子之间的单键为 σ 键、双键中含有 1 个 σ 键,共有 8 个,故答案为:哑铃形; 8 ; 8 ;
( 3 )若在 L 2- 上引入能与水分子形成氢键的羟基和氨基,有利于增强 X 与水分子的吸附作用,若在 L 2- 上引入不能与水分子形成氢键的氯原子、甲基,不能增强 X 与水分子的吸附作用,故选 BC ;
( 4 ) ① 由 X 晶胞的组成单元的对角面可知,晶胞中与同一配体相连的两个 [Zn 4 O] 6+ 的不同之处在于与 Zn 2+ 相连的双键氧原子不在对称轴的同侧,故答案为:与 Zn 2+ 相连的双键氧原子不在对称轴的同侧;
②1 个 [Zn 4 O] 6+ 上、下、左、右、前、后共有 6 个 L 2- ,每个 L 2- 与 [Zn 4 O] 6+ 形成 2 个 Zn←O 配位键, 1 个 [Zn 4 O] 6+ 含有 4 个 Zn←O 配位键, 1 个 [Zn 4 O] 6+ 中 Zn2+ 形成的配位键数目为 6×2+4=16 , 1 个 Zn 2+ 的配位数为 4 ;
③ 由 X 晶胞的组成单元结构可知, [Zn 4 O] 6+ 中两个处于体对角线的氧离子距离、边长和面对角线构成直角三角形,氧离子距离为单元结构的体对角线,设 A 、 B 两个锌离子之间的最短距离为 xnm ,由体对角线的长度可得: x+2d= ,解得 x=
a—2d ,故答案为:
a—2d ;
④ 由 X 晶胞的组成单元结构可知,单元结构中位于顶点的 [Zn 4 O] 6+ 的个数为 8× =1 ,位于棱上的 L 2- 的个数为 12×
=3 ,设晶体的密度为 dg/cm 3 ,由 X 晶体具有面心立方结构,其晶胞由 8 个结构相似的组成单元构成可得:
=(2a×10 —7 ) 3 d ,解得 d=
,故答案为:
。