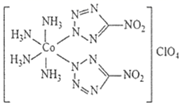
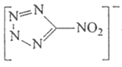
下列说法正确的是
A .金刚石与石墨烯中的 夹角都为
B . 、
都是由极性键构成的非极性分子
C .锗原子 ( ) 基态核外电子排布式为
D . ⅣA 族元素单质的晶体类型相同
答案
B
【详解】 A .金刚石中的碳原子为正四面体结构, 夹角为 109°28′ ,故 A 错误;
B . 的化学键为 Si-H ,为极性键,为正四面体,正负电荷中心重合,为非极性分子;
的化学键为 Si-Cl ,为极性键,为正四面体,正负电荷中心重合,为非极性分子,故 B 正确;
C .锗原子 ( ) 基态核外电子排布式为 [Ar]3d 10
,故 C 错误;
D . ⅣA 族元素中的碳元素形成的石墨为混合晶体,而硅形成的晶体硅为原子晶体,故 D 错误;
故选 B 。


 )、半充满(
)、半充满( )和全空(
)和全空(
 )状态时,体系的能量较低,原子较稳定。
)状态时,体系的能量较低,原子较稳定。