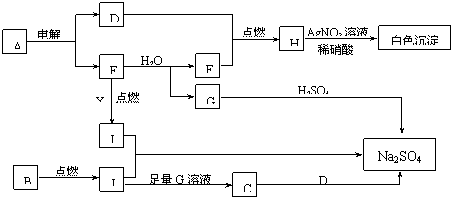
实验室制取少量 水溶液并探究其酸性,下列实验装置和操作不能达到实验目的的是
A .用装置甲制取 气体 B .用装置乙制取
水溶液
C .用装置丙吸收尾气中的 D .用干燥 pH 试纸检验
水溶液的酸性
答案
C
【详解】 A . 60% 硫酸和 NaHSO 3 (s) 可发生反应: H 2 SO 4 +2NaHSO 3 =Na 2 SO 4 +2SO 2 ↑+2H 2 O ,因此装置甲可以制取 气体, A 正确;
B .气体通入液体时 “ 长进短出 ” ,装置乙可以制取 水溶液, B 正确;
C . SO 2 不会与饱和 NaHSO 3 溶液发生反应,因此装置丙不能吸收尾气中的 , C 错误;
D . 水溶液显酸性,可用干燥的 pH 试纸检验其酸性, D 正确;
答案选 C 。


 2SO3
2SO3





 无色溶液
无色溶液 恢复原色。
恢复原色。


 ,如下数轴所示:
,如下数轴所示:
 则固体物质为Na2SO3,
则固体物质为Na2SO3, ,则固体物质为NaOH 和Na2SO3.
,则固体物质为NaOH 和Na2SO3. ,则同体物质为NaHSO3
,则同体物质为NaHSO3 ,则固体物质为Na2SO3和NaHSO3,
,则固体物质为Na2SO3和NaHSO3, ,则固体物质为NaHSO3。
,则固体物质为NaHSO3。