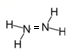
少量 与
反应生成
和
。下列说法正确的是
A . 的电子式为
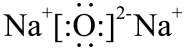 B .
B . 的空间构型为直线形
C . 中 O 元素的化合价为 -1 D .
仅含离子键
答案
C
【详解】 A .过氧化钠是离子化合物,电子式是 ![]() , A 错误;
, A 错误;
B . 中氧原子的成键电子对是 2 ,孤电子对是 2 ,根据价层电子对为 4 ,根据价层电子对互斥理论,其空间构型为 V 形, B 错误;
C . 中 H 显 +1 价,根据正负化合价为 0 ,可计算出 O 的化合价为 -1 , C 正确;
D . 中 O 和 H 之间是共价键, D 错误;
故选 C 。


 D
D