某兴趣小组用四水醋酸锰 [(CH 3 COO) 2 Mn·4H 2 O] 和乙酰氯 (CH 3 COCl) 为原料制备无水二氯化锰,按如图流程开展了实验 ( 夹持仪器已省略 ) :
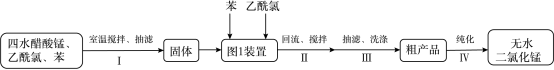
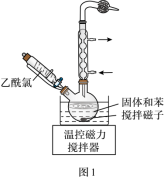

已知: ① 无水二氯化锰极易吸水潮解,易溶于水、乙醇和醋酸,不溶于苯。
② 制备无水二氯化锰的主要反应: (CH 3 COO) 2 Mn+CH 3 COCl MnCl 2 ↓+2(CH 3 COO) 2 O 。
③ 乙酰氯遇水发生反应: CH 3 COCl+H 2 O→CH 3 COOH+HCl 。
请回答:
(1) 步骤 Ⅰ :所获固体主要成分是 ( 用化学式表示 ) 。
(2) 步骤 Ⅰ 在室温下反应,步骤 Ⅱ 在加热回流下反应,目的分别是 。
(3) 步骤 Ⅲ :下列操作中正确的是 。
A .用蒸馏水润湿滤纸,微开水龙头,抽气使滤纸紧贴在漏斗瓷板上
B .用倾析法转移溶液,开大水龙头,待溶液快流尽时再转移沉淀
C .用乙醇作为洗涤剂,在洗涤沉淀时,应开大水龙头,使洗涤剂快速通过沉淀物
D .洗涤结束后,将固体迅速转移至圆底烧瓶进行后续操作
(4) 步骤 Ⅳ : ① 将装有粗产品的圆底烧瓶接到纯化装置 ( 图 2) 上,打开安全瓶上旋塞,打开抽气泵,关闭安全瓶上旋塞,开启加热器,进行纯化。请给出纯化完成后的操作排序: 。
纯化完成 →(_____)→(_____)→(_____)→(_____)→ 将产品转至干燥器中保存
a. 拔出圆底烧瓶的瓶塞
b. 关闭抽气泵
c. 关闭加热器,待烧瓶冷却至室温
d. 打开安全瓶上旋塞
② 图 2 装置中 U 形管内 NaOH 固体的作用是 。
(5) 用滴定分析法确定产品纯度。甲同学通过测定产品中锰元素的含量确定纯度;乙同学通过测定产品中氯元素的含量确定纯度。合理的是 ( 填 “ 甲 ” 或 “ 乙 ”) 同学的方法。
答案
(1)(CH 3 COO) 2 Mn
(2) 步骤 Ⅰ 脱去四水醋酸锰的结晶水并防止生成 MnCl 2 ;步骤 Ⅱ 加热回流促进反应生成 MnCl 2
(3)BD
(4) cdba 防止可能产生的酸性气体进入抽气泵;防止外部水气进入样品
(5) 乙
【详解】( 1 )根据制备无水二氯化锰的主要反应: (CH 3 COO) 2 Mn+CH 3 COCl MnCl 2 ↓+2(CH 3 COO) 2 O 以及乙酰氯遇水发生反应: CH 3 COCl+H 2 O→CH 3 COOH+HCl 可判断步骤 Ⅰ 中利用 CH 3 COCl 吸水,因此所获固体主要成分是 (CH 3 COO) 2 Mn 。
( 2 )由于步骤 Ⅰ 脱去四水醋酸锰的结晶水并防止生成 MnCl 2 ,因此步骤 Ⅰ 在室温下反应;而步骤 Ⅱ 加热回流促进反应生成 MnCl 2 ,所以步骤 Ⅱ 需要在加热回流下反应。
( 3 ) A .因为氯化锰极易吸水潮解,故不能使用水来润湿,可以改用苯等有机溶剂,故 A 错误;
B .用倾析法转移溶液,开大水龙头,待溶液快流尽时再转移沉淀,故 B 正确;
C .用抽滤洗涤沉淀时,抽滤速率不能过快,故 C 错误;
D .由于无水二氯化锰极易吸水潮解,洗涤结束后,将固体迅速转移至圆底烧瓶进行后续操作,故 D 正确;
故答案为 BD ;
( 4 ) ① 纯化完成后首先关闭加热器,待烧瓶冷却至室温,然后打开安全瓶上旋塞,关闭抽气泵,最后拔出圆底烧瓶的瓶塞,将产品转至干燥器中保存,故答案为 cdba ;
② 由于可能混有酸性气体且无水二氯化锰极易吸水潮解,因此图 2 装置中 U 形管内 NaOH 固体的作用是防止可能产生的酸性气体进入抽气泵,同时防止外部水气进入样品。
( 5 )由于无水二氯化锰极易吸水潮解,且锰离子水解,所以应该通过测定产品中氯元素的含量确定纯度,所以合理的是乙同学的方法。




 可知,
可知, 是准 确量取的体积,
是准 确量取的体积, 是标准溶液的浓度,它们均为定值,所以
是标准溶液的浓度,它们均为定值,所以 的大小取决于
的大小取决于 的大小,
的大小, 大则
大则 大,
大, 小则
小则 小。
小。