工业上,以煤炭为原料,通入一定比例的空气和水蒸气,经过系列反应可以得到满足不同需求的原料气。请回答:
(1) 在 C 和 O 2 的反应体系中:
反应 1 : C(s)+O 2 (g)=CO 2 (g) ΔH 1 =-394kJ·mol -1
反应 2 : 2CO(g)+O 2 (g)=2CO 2 (g) ΔH 2 =-566kJ·mol -1
反应 3 : 2C(s)+O 2 (g)=2CO(g) ΔH 3 。
① 设 y=ΔH-TΔS ,反应 1 、 2 和 3 的 y 随温度的变化关系如图 1 所示。图中对应于反应 3 的线条是 。
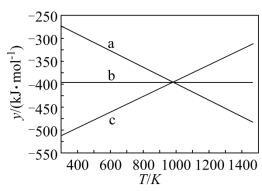
② 一定压强下,随着温度的升高,气体中 CO 与 CO 2 的物质的量之比 。
A .不变 B .增大 C .减小 D .无法判断
(2) 水煤气反应: C(s)+H 2 O(g)=CO(g)+H 2 (g) ΔH=131kJ·mol -1 。工业生产水煤气时,通常 交替通入 合适量的空气和水蒸气与煤炭反应,其理由是 。
(3) 一氧化碳变换反应: CO(g)+H 2 O(g)=CO 2 (g)+H 2 (g) ΔH=-41kJ·mol -1 。
① 一定温度下,反应后测得各组分的平衡压强 ( 即组分的物质的量分数 × 总压 ) : p(CO)=0.25MPa 、 p(H 2 O)=0.25MPa 、 p(CO 2 )=0.75MPa 和 p(H 2 )=0.75MPa ,则反应的平衡常数 K 的数值为 。
② 维持与题 ① 相同的温度和总压,提高水蒸气的比例,使 CO 的平衡转化率提高到 90% ,则原料气中水蒸气和 CO 的物质的量之比为 。
③ 生产过程中,为了提高变换反应的速率,下列措施中合适的是 。
A .反应温度愈高愈好 B .适当提高反应物压强
C .选择合适的催化剂 D .通入一定量的氮气
④ 以固体催化剂 M 催化变换反应,若水蒸气分子首先被催化剂的活性表面吸附而解离,能量 - 反应过程如图 2 所示。

用两个化学方程式表示该催化反应历程 ( 反应机理 ) :步骤 Ⅰ : ;步骤 Ⅱ : 。
答案
(1) a B
(2) 水蒸气与煤炭反应吸热,氧气与煤炭反应放热,交替通入空气和水蒸气有利于维持体系热量平衡,保持较高温度,有利于加快化学反应速率
(3) 9.0 1.8 : 1 BC M+H 2 O=MO+H 2 MO+CO=M+CO 2
【详解】( 1 ) ① 由已知方程式: (2× 反应 1- 反应 2) 可得反应 3 ,结合盖斯定律得: ,反应 1 前后气体分子数不变,升温 y 不变,对应线条 b ,升温促进反应 2 平衡逆向移动,气体分子数增多,熵增, y 值增大,对应线条 c ,升温促进反应 3 平衡逆向移动,气体分子数减少,熵减, y 值减小,对应线条 a ,故此处填 a ;
② 温度升高,三个反应平衡均逆向移动,由于反应 2 焓变绝对值更大,故温度对其平衡移动影响程度大,故 CO 2 物质的量减小, CO 物质的量增大,所以 CO 与 CO 2 物质的量比值增大,故答案选 B ;
( 2 )由于水蒸气与煤炭反应吸热,会引起体系温度的下降,从而导致反应速率变慢,不利于反应的进行,通入空气,利用煤炭与 O 2 反应放热从而维持体系温度平衡,维持反应速率,故此处填:水蒸气与煤炭反应吸热,氧气与煤炭反应放热,交替通入空气和水蒸气有利于维持体系热量平衡,保持较高温度,有利于加快反应速率;
( 3 ) ① 该反应平衡常数 K = ;
② 假设原料气中水蒸气为 x mol , CO 为 1 mol ,由题意列三段式如下: ,则平衡常数 K =
,解得 x=1.8 ,故水蒸气与 CO 物质的量之比为 1.8 : 1 ;
③A .反应温度过高,会引起催化剂失活,导致反应速率变慢, A 不符合题意;
B .适当增大压强,可加快反应速率, B 符合题意;
C .选择合适的催化剂有利于加快反应速率, C 符合题意;
D .若为恒容条件,通入氮气对反应速率无影响,若为恒压条件,通入氮气后,容器体积变大,反应物浓度减小,反应速率变慢, D 不符合题意;
故答案选 BC ;
④ 水分子首先被催化剂吸附,根据元素守恒推测第一步产生 H 2 ,第二步吸附 CO 产生 CO 2 ,对应反应历程依次为: M+H 2 O=MO+H 2 、 MO+CO=M+CO 2 。

 2SO3中通入He,平衡逆向移动原因:体积增大,压强不变,浓度减小,平衡逆向移动。
2SO3中通入He,平衡逆向移动原因:体积增大,压强不变,浓度减小,平衡逆向移动。  随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。
随时间(含条件改变对化学反应速率的影响)变化的观律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向等。




 bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:
bB(g)+ cc(g),增加A的量,平衡向正反应方向移动,但反应物 A的转化率与气体物质的化学计量数有关:
 cC(g)+dD(g):
cC(g)+dD(g): 

 ,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。
,压强的变化对其平衡无影响。这是因为,在这种情况下,压强的变化对正、逆反应速率的影响程度是等同的,故平衡不移动。  ,
, ,当浓度同时增大一倍时,即让
,当浓度同时增大一倍时,即让
 ,此时相当于压强增大一倍,平衡向生成NH3的方向移动。
,此时相当于压强增大一倍,平衡向生成NH3的方向移动。 
 ,平衡后,向容器中再通入反应物
,平衡后,向容器中再通入反应物 ,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小
,使 c(NO2)增大,平衡正向移动;如向容器中再通入生成物 N2O4,则使c(N2O4)增大,平衡逆向移动。但由于两种情况下,容器内的压强都增大,故对最终平衡状态的影响是一致的,如两种情况下,重新达到平衡后,NO2的百分含量都比原平衡时要小