水溶液呈酸性的盐是
A . NH 4 Cl B . BaCl 2 C . H 2 SO 4 D . Ca(OH) 2
答案
A
【详解】 A . NH 4 Cl 盐溶液存在 而显酸性, A 符合题意;
B . BaCl 2 溶液中 Ba 2+ 和 Cl - 均不水解,是强酸强碱盐,溶液显中性, B 不符合题意;
C . H 2 SO 4 属于酸,不是盐类, C 不符合题意;
D . Ca(OH) 2 是碱类物质,溶液显碱性, D 不符合题意;
故选 A 。

 ” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。 

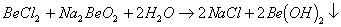 能完全进行,则下列推断中,正确的是
能完全进行,则下列推断中,正确的是 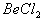 溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO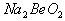 溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO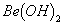 既能溶于盐酸又能溶于烧碱溶液
既能溶于盐酸又能溶于烧碱溶液