砷 (As) 的某些化合物具有独特的性质与用途,如 在医药、电子等领域有重要应用。某化工厂利用含硫化砷 (As 2 S 3 ) 的废料制取 As 2 O 3 ( 微溶于水 ) 的流程如下。
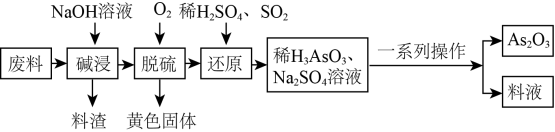
回答下列问题:
(1) 砷与磷是同主族的相邻元素,其在周期表中的位置是 _______ ,从物质化学性质角度看, 不可能是 _______( 填 “ 酸 ” 、 “ 碱 ” 或 “ 两 ”) 性氧化物。
(2) 碱浸液中溶质主要为 和
与 NaOH 反应的离子方程式: _______ 。
(3) 脱硫后以 的形式存在,写出
与
反应的化学方程式: _______ 。还原后砷以
形式存在,则通入
的反应中,氧化剂与还原剂的物质的量之比为 _______ 。
(4) 还原后加热溶液, 分解为
,结晶得到相
,
在不同温度和不同浓度硫酸中的溶解度 (S) 曲线如图所示,为了提高粗
的沉淀率, “ 结晶 ” 过程进行的操作是蒸发浓缩,冷却结晶,过滤,洗涤,在此过程中应控制的条件为 _______ 。

(5) 在工业生产中,最后一步所得滤液可循环使用,其目的是 _______ 。
答案
(1) 第四周期 VA 族 碱
(2)
(3) 1 : 1
(4) 调节硫酸浓度约为 7mol/L ,并将温度冷却至 25℃
(5) 最后一步所得滤液中依然含有砷元素,循环使用可以提高砷的回收率
【分析】由题给流程可知,向废料中加入氢氧化钠溶液碱浸,将硫化砷转化为 Na 3 AsO 3 和 Na 3 AsS 3 ,向碱浸后的溶液中通入氧气,将 Na 3 AsO 3 和 Na 3 AsS 3 转化为 Na 3 AsO 4 和硫沉淀,过滤得到硫和 Na 3 AsO 4 溶液;向溶液中加入稀硫酸酸化后,通入二氧化硫将 Na 3 AsO 4 还原为 H 3 AsO 3 , H 3 AsO 3 和硫酸钠混合溶液经一系列操作得到三氧化二砷和含有砷元素的料液。
( 1 )
磷元素位于元素周期表第三周期 VA 族,由砷与磷是同主族的相邻元素可知,砷元素位于元素周期表第四周期 VA 族,砷元素是非金属元素,所以三氧化二砷不可能是碱性氧化物,故答案为:第四周期 VA 族;碱;
( 2 )
由分析可知,三硫化二砷与氢氧化钠溶液反应生成 Na 3 AsO 3 、 Na 3 AsS 3 和水,反应的离子方程式为 ,故答案为:
;
( 3 )
由分析可知, Na 3 AsS 3 溶液与氧气反应生成 Na 3 AsO 4 和硫沉淀,反应的化学方程式为 ;通入二氧化硫的目的是二氧化硫与 Na 3 AsO 4 溶液发生氧化还原反应生成 H 3 AsO 3 和硫酸钠,由得失电子数目守恒可知,氧化剂 Na 3 AsO 4 与还原剂二氧化硫的物质的量之比为 1 : 1 ,故答案为:
; 1 : 1 ;
( 4 )
由图可知,硫酸浓度为 7mol/L 、温度为 25℃ 时三氧化二砷的溶解度最小,沉淀率最大,则结晶过程中应控制的条件为调节硫酸浓度约为 7mol/L ,并将温度冷却至 25℃ ,故答案为:调节硫酸浓度约为 7mol/L ,并将温度冷却至 25℃ ;
( 5 )
由分析可知,最后一步所得滤液中依然含有砷元素,循环使用可以提高砷的回收率,所以在工业生产中,最后一步所得滤液应循环使用,故答案为:最后一步所得滤液中依然含有砷元素,循环使用可以提高砷的回收率。



