铜是重要的过渡元素,其单质及化合物具有广泛用途。回答下列问题:
(1) 铜元素基态原子的价电子排布式为 _______ 。
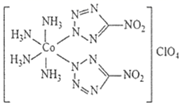
(2) 成多种配合物,如 与乙二胺
可形成如图所示配离子。
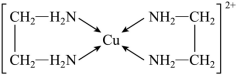
① 与乙二胺所形成的配离子内部粒子间的作用力类型有 _______ 。
A .配位键 B .极性键 C .离子键 D .非极性键 F. 氢键 F. 金属键
② 乙二胺分子中氮原子的杂化轨道类型为 _______ , C 、 N 、 H 三种元素的电负性由大到小顺序是 _______ 。
(3) 乙二胺和三甲胺 [ ] 均属于胺,乙二胺的沸点比三甲胺高很多,原因是 _______ 。
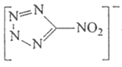
在水溶液中以
形式存在,向含
的溶液中加入足量氨水,可生成更稳定的
,其原因是 _______ 。
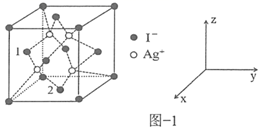
(4)Cu 和 S 形成某种晶体的晶胞如图所示。
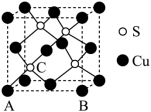
① 该晶胞原子坐标参数 A 为 (0 , 0 , 0) ; B 为 (1 , 0 , 0) 。则 C 原子的坐标参数为 _______
② 已知该晶体的密度为 ,
和
的半径分别为
和
,阿伏加德罗常数值为 _______
。列式表示该晶体中原子的空间利用率 _______ 。
答案
(1)3d10 4s1
(2) ABD sp3 N > C > H
(3) 乙二胺分子间可形成氢键,三甲胺分子间不能形成氢键; N 元素电负性更小,更易给出孤对电子形成配位键;
(4) ( ,
,
)
【解析】( 1 )
铜元素基态原子中 3d 、 4s 能级上电子为其价电子, 3d 能级上有 10 个电子、 4s 能级上有 1 个电子,其价电子排布式为 3d10 4s1 ;
故答案为 3d10 4s1 ;
( 2 )
①Cu 2+ 与乙二胺所形成的配离子内部粒子间含有 C−N 、 C−H 、 N−H 、 C−C 和 N−Cu 键, C−N 、 C−H 和 N−H 为极性键, C−C 非极性键, N−Cu 之间的化学键是配位键;
故答案为 ABD ;
② 乙二胺分子中氮原子价层电子对个数是 4 且不含孤电子对,根据价层电子对互斥理论判断 N 原子的杂化轨道类型为 sp3 ,元素的非金属性越强,其电负性越大,电负性大小顺序是 N > C > H ;
故答案为 sp3 ; N > C > H ;
( 3 )
乙二胺分子中 N 原子上连接有氢原子,可形成氢键,而三甲胺分子中氮原子上没有连接氢原子,不能形成氢键,故乙二胺的沸点比三甲胺高很多;向含 Cu 2 + 的溶液中加入足量氨水,可生成更稳定的 [Cu(NH 3 ) 4 ] 2 + ,是因为 N 元素电负性更小,更易给出孤对电子形成配位键;
故答案为乙二胺分子间可形成氢键,三甲胺分子间不能形成氢键; N 元素电负性更小,更易给出孤对电子形成配位键;
( 4 )
①C 点位于体对角线的 处,根据 A 点和 B 点的晶胞参数,容易写出 C 的晶胞参数为(
,
,
);
故答案为( ,
,
);
② 阿伏加德罗常数值为 ;该晶胞是面心立方最密堆积,每个面上对角线上的 3 个 Cu 原子紧密相连,则晶胞棱长=
, 晶胞体积=
,该晶胞中 Cu 原子个数=
, S 原子个数是 4 ,所有原子体积=
,该晶体中原子的空间利用率=
;
故答案为 ,
。


 )、半充满(
)、半充满( )和全空(
)和全空(
 )状态时,体系的能量较低,原子较稳定。
)状态时,体系的能量较低,原子较稳定。