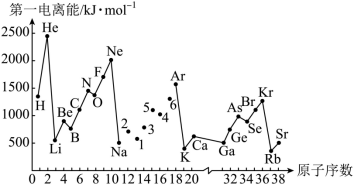
第一电离能 I 1 是指气态原子 X(g) 处于基态时,失去一个电子成为气态阳离子 X + (g) 所需的能量。如下图所示是部分元素原子的第一电离能 (I 1 ) 随原子序数变化的曲线图。
请回答以下问题:
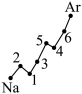
(1) 认真分析上图中同周期元素第一电离能的变化规律,将 Na~Ar 八种元索用短线连接起来,构成完整的图象 ______ 。
(2) 从上图分析可知,同 一主族元素的第一电离能 (I 1 ) 变化规律是 ___________ 。
(3) 上图中 5 号元素在元素周用表中的位置是 ___________ 。
(4) 上图中 4 、 5 、 6 号三种元素中电负性最大的是 ___________( 填元素符号 ) 。
答案
(1) 
(2) 从上到下依次减小
(3) 第三周期 ⅤA 族
(4)Cl
【详解】( 1 )根据处于全充满、半充满时稳定性强可知 Na ~ Ar 元素中, Mg(3s 2 ) 比 Na(3s 1 ) 、 Al(3s 2 3p 1 ) 失去一个电子成为气态阳离子 X + (g) 所需的能量大, P(3s 2 3p 3 ) 比 Si(3s 2 3p 2 ) 、 S(3s 2 3p 4 ) 失去一个电子成为气态阳离子 X + (g) 所需的能量大,因此图象为 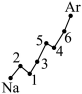 ;
;
( 2 )同一主族元素原子的第一电离能 I 1 变化规律是从上到下,随着原子核外电子层数的增加,第一电离能依次减小;
( 3 )上图中 5 号元素是 15 号元素 P ,其在周期表中的位置是第三周期 ⅤA 族;
( 4 )图中 4 、 5 、 6 号三种元素分别是 S 、 P 、 Cl ,同周期元素从左到右非金属性增强,其电负性增大,则电负性最大的是 Cl 元素。