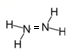
向 CuSO 4 溶液中通入 H 2 S ,会生成 CuS 沉淀,反应为 CuSO 4 +H 2 S=CuS↓+H 2 SO 4 。下列有关说法正确的是
A . SO 的空间构型为三角锥形 B . H 2 S 属于电解质
C . Cu 在周期表中位于 d 区 D . S 2- 的结构示意图为 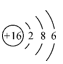
答案
B
【详解】 A . SO 中 S 成 4 个
键,价层电子对为 4 ,采取 sp 3 杂化,空间构型为四面体形,故 A 错误;
B .在水溶液或熔融态能导电的化合物属于电解质, H 2 S 的水溶液可以导电,属于电解质,故 B 正确;
C . Cu 的价电子排布为 3d 10 4s 1 ,在周期表中位于 ds 区,故 C 错误;
D . S 2- 核外有 18 个电子, S 2- 的结构示意图为 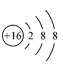 ,故 D 错误;
,故 D 错误;
故答案为 B 。


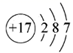 D
D