为阿伏伽德罗常数,下列说法正确的是
A .标况下, 含有
的数目是
B . 与足量水反应转移电子的数目是
C . 溶液中含有
的数目是
D . 中含有的电子数是
答案
B
【详解】 A .标况下三氯甲烷为液态,不能使用气体摩尔体积计算其物质的量,故 A 错误;
B . 7.8gNa 2 O 2 与物质的量为: ,与水的反应,转移 0.1N A 个电子,故 B 正确;
C .铝离子为弱碱阳离子,水溶液中部分水解,所以 200ml0.2mol/LAl 2 (SO 4 ) 3 溶液中含有 Al 3+ 的数目小于 0.08N A ,故 C 错误;
D . 的物质的量为
,含有的电子数是: 0.45mol×10×N A mol -1 =4.5N A ,故 D 错误;
故选: B 。

 ” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。
” 水解是吸热过程,是中和反应的逆过程。一般,水解的程度较小,写离子方程式时,不能用“↑”或“↓”符号。多元弱酸根分步水解,以第一步为主。多元弱碱阳离子一步水解。 

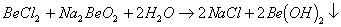 能完全进行,则下列推断中,正确的是
能完全进行,则下列推断中,正确的是 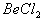 溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH<7,将其蒸干并灼烧后,得到的残留物可能为BeO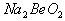 溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO
溶液的pH>7,将其蒸干并灼烧后,得到的残留物可能为BeO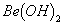 既能溶于盐酸又能溶于烧碱溶液
既能溶于盐酸又能溶于烧碱溶液