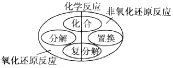
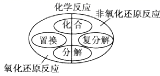
下列是某兴趣小组在学习碱的性质时进行的探究活动,请按要求回答问题。
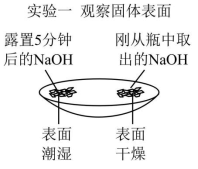
(1) 通过分析实验一可知,氢氧化钠会吸收空气中的 _______ 。
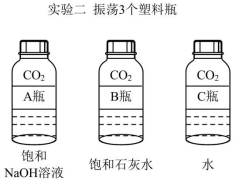
(2) 实验二中观察到 3 个塑料瓶变瘪的程度为 A>B>C ,可证明 CO 2 能与 NaOH 、 Ca(OH) 2 反应,其中 C 瓶在实验中起 _______ 作用。
(3) 晓晓查阅资料了解到往 Ba(OH) 2 溶液中滴加或通入下列物质会产生如图现象: A 中溶液显红色, B 、 C 、 D 中均产生白色沉淀。
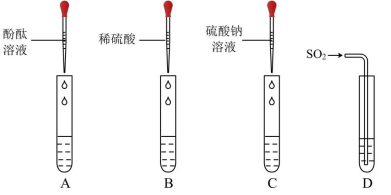
① 写出 D 试管中反应的化学方程式 _______ 。
② 不同的碱溶液中都含有 OH - ,所以,碱有一些相似的化学性质。上述关于 Ba(OH) 2 性质的实验不能体现碱的相似性质的是 _______( 填字母序号 ) 。
(4) 冬冬发现工业上使用的氢氧化钠固体标签如图所示,于是对其所含杂质进行了探究。

【提出问题】 _______ 。
【提出猜想】猜想 Ⅰ :查阅资料可知,工业用氢氧化钠可能含有 NaCl 。
猜想 Ⅱ :工业用氢氧化钠可能含有 Na 2 CO 3 ,原因是 _______( 用简洁的文字表述 ) 。
【进行实验】
| 实验步骤 | 实验现象 | 解释或结论 |
| ① 取适量固体样品于试管中,加水溶解 | 固体全部溶解 | |
| ② 向 ① 所得溶液中滴加过量的 _______ | 一开始无明显变化,一会儿后产生能使澄清石灰水变浑浊的气体 | 样品中含有 Na 2 CO 3 |
| ③ 向 ② 所得溶液中滴加几滴硝酸银溶液 | 产生白色沉淀 | 样品中还含有 NaCl 。反应的化学方程式为 _______ |
答案
(1) 水蒸气
(2) 对照
(3) Ba(OH) 2 +SO 2 = BaSO 3 ↓+H 2 O C
(4) 工业用氢氧化钠中还含有哪些杂质 氢氧化钠易吸收空气中的 CO 2 生成 Na 2 CO 3 稀硝酸 AgNO 3 +NaCl= NaNO 3 +AgCl↓
【分析】二氧化碳、二氧化硫是酸性氧化物,能与碱反应生成盐和水;硫酸根离子和钡离子反应生成硫酸钡沉淀;碳酸钠与酸反应放出二氧化碳气体,用硝酸银溶液检验氯离子。
(1)
刚取出的氢氧化钠表面干燥,一段时间后表面湿润,说明氢氧化钠会吸收空气中的水蒸气;
(2)
C 瓶变瘪的程度最小,说明 A 、 B 变瘪不是因为二氧化碳溶于水,所以 C 瓶在实验中起对照作用;
(3)
①D 试管中氢氧化钡和二氧化硫反应生成亚硫酸钡沉淀和水,反应的化学方程式为 Ba(OH) 2 +SO 2 = BaSO 3 ↓+H 2 O 。
② 不同的碱溶液中都含有 OH - ,所以碱有一些相似的化学性质。 C 中反应的实质是 ,与 OH - 无关,所以上述关于 Ba(OH) 2 性质的实验不能体现碱的相似性质的是 C 。
(4)
根据猜想 Ⅰ 、猜想 Ⅱ ,可知冬冬提出的问题是工业用氢氧化钠中还含有哪些杂质;氢氧化钠易吸收空气中的 CO 2 生成 Na 2 CO 3 ,所以猜测工业用氢氧化钠可能含有 Na 2 CO 3 ;
② 碳酸钠和硝酸反应放出二氧化碳气体,向 ① 所得溶液中滴加过量的稀硝酸,产生能使澄清石灰水变浑浊的气体,说明样品中含有 Na 2 CO 3 ;向 ② 所得溶液中滴加几滴硝酸银溶液,生成白色沉淀,说明发生反应 AgNO 3 +NaCl= NaNO 3 +AgCl↓ ,证明样品中含有 NaCl 。

 B
B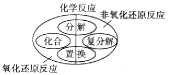
 D
D