硅、硫、氮等非金属元素在化工生产中扮演着重要角色。
I. 下列物品或设施:
① 陶瓷餐具; ② 门窗玻璃; ③ 水晶镜片; ④ 硅太阳能电池; ⑤ 光导纤维; ⑥ 手机芯片。
(1) 直接使用了硅单质的是 ( 用序号填空 )_______
II. 在学习了硫的转化后,某学生绘制了如图转化关系。
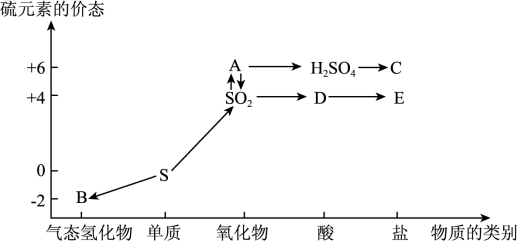
(2) 写出简单气态氢化物 B 的结构式: _______ 。
(3) 写出 转化为 A 的化学方程式: _______ 。
(4) 下列五种有色溶液与 作用均能褪色
① 品红溶液; ② 酸性 溶液; ③ 溴水; ④ 滴有酚酞的 NaOH 溶液; ⑤ 淀粉 - 碘溶液
体现了 还原性的是 ( 用序号填空 )_______ 。写出
通入酸性
溶液反应的离子方程式: _______ 。
(5) 工业生产中利用氨水吸收 和
,原理如图所示:
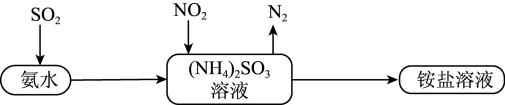
被吸收过程的离子方程式是 _______ 。
(6) 硝酸是一种具有强氧化性、腐蚀性的强酸。已知 25.6gCu 与过量的 300mL 、 6mol/L 硝酸充分反应,反应结束后,除了产生 以外,还产生了 NO 与
两种气体共 13.44L( 标况下测定 ) ,请计算 ( 忽略反应前后溶液体积的变化 ) :反应产生的混合气体中,产生 NO 气体的体积为 _______L( 标准状况下测定 ) 。
答案
(1)④⑥
(2)H-S-H
(3)
(4) ②③⑤ 5SO 2 +2MnO +2H 2 O=5SO
+2Mn 2+ +4H +
(5)2NO 2 +4SO =N 2 +4SO
(6)2.24
【解析】
(1)
硅为良好的半导体材料,可用于硅太阳能电池、手机芯片,故答案为 ④⑥ ;
(2)
B 中硫元素为 -2 价且为气态氢化物,因此 B 为 H 2 S 其结构式 H-S-H ;
(3)
A 中 S 元素为 +6 价且属于氧化物,因此 A 为 SO 3 , SO 2 转化为 A 的化学方程式 ;
(4)
① 二氧化硫能漂白某些有色物质,如使品红溶液褪色是特征反应,化合生成不稳定的化合物加热后又恢复为原来的红色; ② 酸性高锰酸钾能将二氧化硫在水溶液中氧化成硫酸,自身还原为无色的二价锰离子,是酸性高锰酸钾的氧化性的体现,这里体现的是二氧化硫的还原性; ③ 溴水可以将二氧化硫氧化为硫酸,自身还原为溴化氢,这里同样体现的是二氧化硫的还原性; ④ 二氧化硫能跟滴有酚酞的氢氧化钠反应生成亚硫酸钠,没有价态变化,是复分解反应,不过亚硫酸钠水解显碱性,但水解较微弱,现象只能是颜色变浅不是褪色; ⑤ 淀粉遇碘变蓝色,碘可以将二氧化硫氧化为硫酸,自身还原为碘化氢是溶液褪色,体现的是二氧化硫的还原性;体现了 SO 2 还原性的是 ②③⑤ ; SO 2 与 KMnO 4 溶液发生的是氧化还原反应,其对应的离子方程式: 5SO 2 +2MnO +2H 2 O=5SO
+2Mn 2+ +4H + ;
(5)
由流程图知,二氧化硫通入氨水中生成亚硫酸铵,利用亚硫酸铵中 SO 的还原性吸收 NO 2 , SO
被氧化为 SO
, NO 2 被还原为 N 2 ,离子方程式为: 2NO 2 +4SO
=N 2 +4SO
;
(6)
25.6gCu 物质的量为 =0.4mol , NO 与 NO 2 两种气体共 13.44L ,物质的量为
=0.6mol ,设 NO 与 NO 两种气体的物质的量分别为 x 、 y ,则依据题意可知 x+y=0.6 ,依据得失电子守恒得: 3x+y=0.4×2 ,方程式联立 x=0.1mol , y=0.5mol , NO 标况下体积为: 0.1mol×22.4L/mol=2.24L 。



