海洋是生命的摇篮,浩瀚的海洋中蕴藏着丰富的资源。人们可以从海水中提取淡水和制得一些重要的化工产品。从海水提溴工艺流程如下图所示:
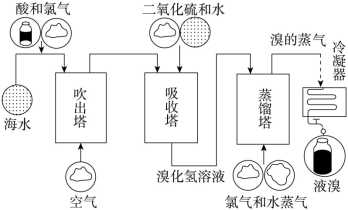
(1) 工业上通过 制备 Mg ,常用的冶炼方法是 _______ 。通入热空气吹出
,利用了溴的 _______ ( 填序号 ) 。
A .氧化性 B .还原性 C .挥发性 D .腐蚀性
(2) 写出吸收塔中反应的离子方程式 _______ 。
(3) 某同学提出,证明溴化氢溶液中含有溴离子的实验方案是:取出少量溶液,先加入过量新制氯水,再加入 KI 淀粉溶液,观察溶液是否变蓝色。该方案是否合理并简述理由 _______ 。
(4) 蒸馏塔在蒸馏过程中,温度应控制在 80~90℃ 。温度过高或过低都不利于生产,请解释原因 _______ 。
(5) 从海水中获得淡水的主要方法有电渗析法、离子交换法和 _____ ( 填一种 ) 。离子交换法净化水的过程如图所示。下列说法正确的是 _______ ( 填序号 ) 。
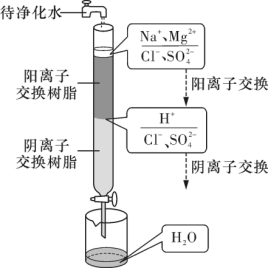
A .经过阳离子交换树脂后,水中阳离子总数减少
B .通过阴离子交换树脂后,水中只有 被除去
C .通过净化处理后的水,导电性增强
D .阴离子交换树脂填充段存在反应:
答案
(1) 电解 C
(2)
(3) 不合理,方案想让氯水中的氯气氧化溴离子,溴单质再氧化碘离子,但氯水是过量的,过量的氯水也能氧化碘离子生成碘单质, ,遇到淀粉也会变蓝色
(4) 温度过高,大量水蒸气随溴排出,溴蒸汽中水蒸气含量增加,温度过低,溴不能完全蒸出,产率较低
(5) 蒸馏法 D
【解析】
( 1 )工业上通过电解熔融的 制备 Mg ,所以常用的冶炼方法是电解,溴易挥发,所以通入热空气吹出
,故答案为:电解; C ;
( 2 )吸收塔中二氧化硫和水的混合物吸收热空气吹出的溴,反应的离子方程式为 ,故答案为:
;
( 3 )不合理,因为过量的氯水也能氧化碘离子生成碘单质, ,遇到淀粉也会变蓝色,故答案为:不合理,因为过量的氯水也能氧化碘离子生成碘单质,
,遇到淀粉也会变蓝色;
( 4 )蒸馏塔在蒸馏过程中,温度应控制在 80~90℃ 。温度过高或过低都不利于生产,因为温度过高,大量水蒸气随溴排出,溴蒸汽中水蒸气含量增加,温度过低,溴不能完全蒸出,产率较低,故答案为:温度过高,大量水蒸气随溴排出,溴蒸汽中水蒸气含量增加,温度过低,溴不能完全蒸出,产率较低;
( 5 )从海水中获得淡水的主要方法有电渗析法、离子交换法和蒸馏法; A .离子交换时,按电荷守恒进行,经过阳离子交换树脂后, 1 个 Mg 2+ 被 2 个 H + 替换,所以水中阳离子总数增多, A 错误; B .通过阴离子交换树脂后,水中 Cl - 、 都被除去, B 错误; C .通过净化处理后的水,离子浓度大大减小,导电性减弱, C 错误; D .阴离子交换树脂填充段生成 OH - ,与阳离子交换树脂段生成的 H + 结合,从而存在反应 H + + OH - = H 2 O , D 正确;故答案为:蒸馏法; D 。



