常温下,将 Cl 2 缓慢通入水中至饱和,然后向所得饱和氯水中滴加 0.1mol·L -1 NaOH 溶液,整个实验进程中溶液的 pH 变化曲线如图所示,下列叙述正确的是
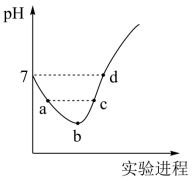
A .向 a 点所示溶液中通入 SO 2 ,溶液的酸性和漂白性均增强
B . b 点所示的溶液中: c(H + )>c(Cl - )>c(HClO)>c(ClO - )>c(OH - )
C . a 点和 c 点溶液中水的电离程度相同
D . d 点所示溶液中: c(Na + )=c(ClO - )+2c(HClO)
答案
B
【解析】
【分析】
将 Cl 2 缓慢通入水中发生反应 ,向右进行的过程,故 a 点是 HCl 和 HClO 的混合溶液,两种酸都会抑制水的电离,从 b 点开始滴加氢氧化钠, c 点时随着 NaOH 溶液的加入,反应生成了 NaCl 和 NaClO ,其中次氯酸根离子会水解,从而促进水的电离,以此解题。
【详解】
A .氯气具有氧化性,能将二氧化硫氧化为硫酸,自身被还原为盐酸,所得到的溶液不再具有漂白性, A 错误;
B . b 点所示溶液中发生反应: Cl 2 +H 2 O H + +Cl - +HClO , HClO 为弱电解质,部分电离,溶液中存在的粒子有: H + 、 Cl - 、 ClO - 、 OH - , H 2 O 、 HClO 、 Cl 2 ,溶液中: c(H + )>c(Cl - )>c(HClO)>c(ClO - )>c(OH - ) , B 正确;
C .由分析可知 a 点时水的电离被抑制,但是在 c 点却存在次氯酸根离子,次氯酸根的水解促进了水的电离, C 错误;
D . d 点溶液呈中性,则 c(H + )=c(OH - ) ,根据电荷守恒得, ,所以
,根据物料守恒得,
,所以
, D 错误;
故选 B 。




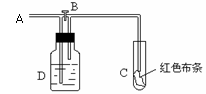
 2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2
2NaCl(反应剧烈,产生大量白烟) 2Fe+3Cl2 2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2
2FeCl3(反应剧烈,产生大量棕褐色烟,溶于水成黄色溶液) Cu+Cl2 CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。
CuCl2(反应剧烈,产生大量棕色的烟,溶于水成蓝色或绿色溶液)氯气能与绝大数金属都能发生反应,表明氯气是一种活泼的非金属单质。  2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2
2HCl(纯净的氢气在氯气中安静的燃烧,芒白色火焰,在瓶口处有白雾产生)H2+Cl2 2HCl(发生爆炸) 2P+3Cl2
2HCl(发生爆炸) 2P+3Cl2 2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。
2PCl3(液态) PCl3+Cl2==PCl5(固态)磷在氯气中剧烈燃烧,产生大量的烟、雾。雾是PCl3,烟是PCl5。氯气能有很多非金属单质反应,如S、C、Si等。  HCl+HClO
HCl+HClO