某实验团队研究合成氨在不同条件下进行反应,平衡时氨气的含量与起始氢氮比 之间的关系如下图。下列说法正确的是
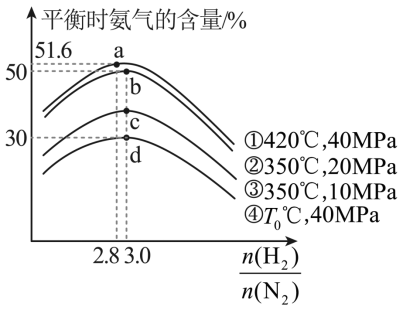
A . <420℃
B . b 点时的转化率:
C . a 、 b 、 c 、 d 四点对应的平衡常数由大到小的顺序为
D .工业合成氨一般以 α- 铁触媒为催化剂, 400~500℃ 下反应,选取该温度的主要原因是氨的平衡产率更高
答案
C
【解析】
【详解】
A .已知合成氨的反应 N 2 +3H 2 2NH 3 是一个放热反应,升高温度,平衡逆向移动, NH 3 的百分含量减小,由曲线 ①④ 可知,
> 420℃ , A 错误;
B .由图可知, b 点时 n(H 2 )/n(N 2 )=3 ,故平衡的转化率: , B 错误;
C .已知合成氨的反应 N 2 +3H 2 2NH 3 是一个放热反应,升高温度,平衡逆向移动,化学平衡常数减小,温度不变,平衡常数不变,由 A 项分析可知, T 0 > 420℃ ,故 a 、 b 、 c 、 d 四点对应的平衡常数由大到小的顺序为
, C 正确;
D .催化剂不能使化学平衡发生移动,故工业合成氨一般以 α- 铁触媒为催化剂, 400~500℃ 下反应,选取该温度的主要原因不是氨的平衡产率更高,而是该温度下催化剂的活性最强, D 错误;
故答案为: C 。




