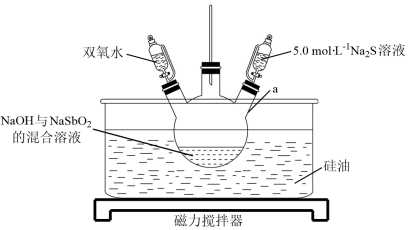
硫代锑酸钠晶体 (Na 3 SbS 4 ·9H 2 O , M =481g·mol -1 ) 为淡黄色晶体,不溶于乙醇、苯等有机溶剂,可溶于水,其水溶液呈强碱性,常用作生物碱试剂。实验室制备硫代锑酸钠的实验装置如图所示 ( 夹持装置略去 ) 。
实验步骤如下:
I. 按如图组装仪器,并将 NaOH 与 NaSbO 2 的混合溶液加入仪器 a 中。
II. 将硅油加热至 60℃ 并保持恒温,缓慢滴加双氧水并不断搅拌,反应 30min ,制备 NaSb(OH) 6 。
III. 升高油浴温度至 98~100℃ ,加热 10min 。
IV. 维持温度为 98~100℃ ,滴加 5.0mol·L -1 Na 2 S 溶液,搅拌 3h 。
V. 趁热过滤,滤液经冷却结晶、过滤、洗涤、干燥后,得到硫代锑酸钠晶体。
回答下列问题:
(1) 仪器 a 的名称为 ____ ;长导管的作用为 ____ 。
(2)“ 步骤 II” 中,需控制反应温度为 60℃ 的原因为 ____ ; “ 步骤 III” 的目的为 ____ 。
(3)“ 步骤 IV” 的化学方程式为 ____ 。
(4)“ 步骤 V” 中,洗涤晶体所选用的最佳试剂为 ____( 填选项字母 ) 。
A .蒸馏水 B .乙醇 C .苯 D .稀盐酸
(5) 硫代锑酸钠晶体中常混有 Na 2 S 杂质,实验室可采用下列实验步骤测定其纯度:
i. 取 9.62g 硫代锑酸钠晶体与亚硫酸钠在沸水中发生反应 (SbS +SO
=SbS
+S 2 O
) ;
ii. 用碳酸锌悬浊液除去硫化钠,反应一段时间后过滤;
iii. 向滤液中滴加 5mL 淀粉溶液,用 c mol·L -1 的碘标准溶液滴定 (I 2 +2S 2 O =2I - +S 4 O
) 。
①“ 步骤 iii” 中,达到滴定终点时的现象为 ____ 。
② 达到滴定终点时,消耗 V mL 碘标准溶液,则样品中硫代锑酸钠晶体的纯度为 ____%( 用含 c 、 V 的代数式表示 ) 。
③ 若省略 “ 步骤 ii” ,会导致测得硫代锑酸钠晶体的纯度 ____( 填 “ 偏低 ” 、 “ 偏高 ” 或 “ 无影响 ”) 。
答案
(1) 三颈烧瓶 平衡气压
(2) 温度过低反应速率慢,温度过高 H 2 O 2 会分解,降低 H 2 O 2 的利用率 除去溶液中过量的 H 2 O 2
(3)NaSb(OH) 6 +4Na 2 S=Na 3 SbS 4 +6NaOH
(4)B
(5) 溶液由无色变为蓝色,且半分钟内不褪色 10 cV 偏高
【解析】
【分析】
将 NaOH 与 NaSbO 2 的混合溶液加入三颈烧瓶中,将水槽内硅油加热至 60℃ 并保持恒温,缓慢滴加双氧水且通过磁力搅拌器不断搅拌,反应 30min ,制备 NaSb(OH) 6 ;升高油浴温度至 98~100℃ ,加热 10min ,维持此温度,滴加 5.0mol·L -1 Na 2 S 溶液,搅拌 3h ;趁热过滤,滤液经冷却结晶、过滤、洗涤、干燥后,得到硫代锑酸钠晶体。
(1)
根据图示,仪器 a 是三颈烧瓶;长导管连通三颈烧瓶与外界空气,作用为平衡气压。
(2)
“ 步骤 II” 中,需缓慢滴加双氧水,控制反应温度为 60℃ 是由于温度过低反应速率慢,温度过高 H 2 O 2 会分解,降低 H 2 O 2 的利用率; “ 步骤 III” 升高体系温度,可除去溶液中过量的 H 2 O 2 。
(3)
“ 步骤 IV” 在 98~100℃ 环境下滴加 5.0mol·L -1 Na 2 S 溶液,与前步骤生成的 NaSb(OH) 6 反应得到 Na 3 SbS 4 产品,化学方程式为: NaSb(OH) 6 +4Na 2 S=Na 3 SbS 4 +6NaOH 。
(4)
根据题给信息,硫代锑酸钠晶体不溶于乙醇、苯等有机溶剂,可溶于水,由于苯有毒, “ 步骤 V” 中,洗涤晶体所选用的最佳试剂为乙醇,选 B 。
(5)
① 由于淀粉溶液遇碘溶液显蓝色, “ 步骤 iii” 中,达到滴定终点时最后滴加的的碘溶液不再与 S 2 O 反应而使溶液呈蓝色,故达到滴定终点时现象为溶液由无色变为蓝色,且半分钟内不褪色。
② 达到滴定终点时,消耗 V mL 碘标准溶液,则步骤 i 反应后溶液 S 2 O 物质的量为
=0.002 cV mol ,根据反应方程式 SbS
+SO
=SbS
+S 2 O
可得,则样品中硫代锑酸钠晶体的物质的量为 0.002 cV mol ,纯度为
。
③ 由于 I 2 能与硫化钠发生氧化还原反应,若省略 “ 步骤 ii” ,会导致杂质 Na 2 S 消耗的碘标准溶液也计算进去,使测得硫代锑酸钠晶体的纯度偏高。