以 CO 和 H 2 为原料合成甲醇是工业上的成熟方法,直接以 CO 2 为原料生产甲醇是目前的研究热点。我国科学家用 CO 2 人工合成淀粉时,第一步就需要将 CO 2 转化为甲醇。
已知: ①CO(g)+2H 2 (g) CH 3 OH(g) ΔH 1 =-90.5kJ•mol -1
②CO(g)+H 2 O(g) CO 2 (g)+H 2 (g) ΔH 2 =-41.1kJ•mol -1
③2H 2 (g)+O 2 (g)=2H 2 O(g) ΔH 3 =-483.6kJ•mol -1
下列说法 不正确 的是
A .若温度不变,反应 ① 中生成 1mol CH 3 OH(l) 时,放出的热量大于 90.5kJ
B . CO 2 与 H 2 合成甲醇的热化学方程式为: CO 2 (g)+3H 2 (g) CH 3 OH(g)+H 2 O(g) ΔH=-49.4kJ•mol -1
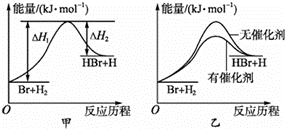
C .通过电解制 H 2 和选用高效催化剂,可降低 CO 2 与 H 2 合成甲醇的反应的焓变
D .以 CO 2 和 H 2 O 为原料合成甲醇,同时生成 O 2 ,该反应需要吸收能量
答案
C
【解析】
【详解】
A . 1molCH 3 OH ( g )能量高于 1molCH 3 OH ( l ),反应物的总能量相同,根据能量守恒定律,若温度不变,反应 ① 中生成 1molCH 3 OH ( l )时,放出的热量大于 90.5kJ ,故 A 正确;
B .根据盖斯定律 ①-② 得反应 ④CO 2 (g)+3H 2 (g) CH 3 OH(g)+H 2 O(g)ΔH= ( -90.5+41.1 ) kJ•mol -1 =-49.4kJ•mol -1 ,故 B 正确;
C .催化剂可降低 CO 2 与 H 2 合成甲醇的反应的活化能,但不改变反应的焓变,故 C 错误;
D .根据盖斯定律 ④×2-③×3 得 2CO 2 (g)+4H 2 O(g) 2CH 3 OH(g)+3O 2 (g) ΔH= ( -49.4×2+483.6×3 ) kJ/mol=+1352kJ/mol > 0 ,则该反应需要吸收能量,故 D 正确;
故选 C 。