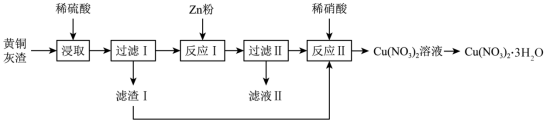
用黄铜灰渣 ( 含有 Cu 、 Zn 、 CuO 、 ZnO 及少量 FeO 、 Fe 2 O 3 ) 生产晶体 Cu(NO 3 ) 2 ·3H 2 O 的流程如图所示,下列说法正确的是
A . “ 浸取 ” 时使用浓硫酸可加快反应速率
B .滤液 II 中一定含 Zn 2+ 、 Fe 2+ 、 SO 离子
C .若制得纯度较高的 Cu(NO 3 ) 2 ·3H 2 O ,反应中所加 Zn 需过量
D .将 Cu(NO 3 ) 2 溶液蒸发浓缩、冷却结晶、过滤得到 Cu(NO 3 ) 2 ·3H 2 O
答案
B
【解析】
【分析】
黄铜灰渣含有 Cu 、 Zn 、 CuO 、 ZnO 及少量 FeO 、 Fe 2 O 3 ,加入稀硫酸, Cu 不溶于稀硫酸,滤渣 Ⅰ 是 Cu ; Zn 、 CuO 、 ZnO 、 FeO 、 Fe 2 O 3 和硫酸反应生成 Zn 2+ 、 Cu 2+ 、 Fe 2+ 、 Fe 3+ ,铜把少量的 Fe 3+ 还原为 Fe 2+ ,加入适量的锌粉,把 Cu 2+ 还原为 Cu ,铜和稀硝酸反应生成硝酸铜溶液,蒸发浓缩、冷却到 30℃ 以上结晶、过滤得到 Cu(NO 3 ) 2 ·3H 2 O 。
【详解】
A .浓硫酸中氢离子浓度小, “ 浸取 ” 时使用浓硫酸不能加快反应速率,故 A 错误;
B .加入适量的锌粉,把 Cu 2+ 还原为 Cu ,所以滤液 II 中一定含 Zn 2+ 、 Fe 2+ 、 SO 离子,故 B 正确;
C .若反应 Ⅰ 中加入过量的 Zn ,得到的固体中 Cu 中含有 Zn 、 Fe 杂质,产品 Cu(NO 3 ) 2 ·3H 2 O 中含有硝酸锌、硝酸铁,故 C 错误;
D . Cu 2+ 会水解,故在蒸发 Cu(NO 3 ) 2 溶液时,要加硝酸抑制 Cu 2+ 水解,再冷却结晶,故 D 错误;
选 B 。