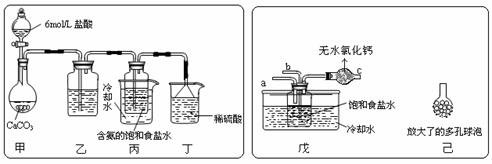
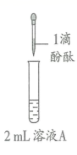
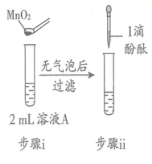
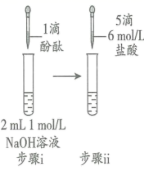
研究小组探究 Na 2 O 2 与水反应。取 1.56 g Na 2 O 2 粉末加入到 40 mL 水中,充分反应得溶液 A( 液体体积无明显变化 ) ,进行以下实验。
| 编号 | ① | ② | ③ | ④ |
| 操作 | | | | |
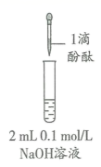
| 现象 | 溶液变红色, 20 秒后褪色 | i. 产生大量能使带火星木条复燃的气体 ii. 溶液变红色, 10 分钟 后褪色 | i. 溶液变红色, 10 分钟后溶液褪色 . ii. 变红色 | 溶液变红色, 2 小时后无明显变化 |
下列说法 不正确 的是
A . 由 ②中现象 i 可知, Na 2 O 2 与水反应有 H 2 O 2 生成
B . 由 ③、④可知,②中溶液红色褪去是因为 c (OH - ) 大
C . 由 ②、③、④可知,①中溶液红色褪去的主要原因不是 c ( OH - ) 大
D . 向 ①中褪色后的溶液中滴加 5 滴 6 mol/L 盐酸,溶液最终变成红色
答案
D
【分析】
1.56 g Na 2 O 2 的物质的量 = =0.02mol ,加入到 40 mL 水中,充分反应得溶液 A( 液体体积无明显变化 ) ,完全反应生成氢氧化钠,则氢氧化钠的浓度为
=1mol/L ,结合实验现象分析判断。
【详解】
A .过氧化钠与水反应得到的溶液 A 中加入二氧化锰,有气体放出,该气体能使带火星木条复燃,说明是氧气,是过氧化氢在二氧化锰催化作用下发生了分解,说明 Na 2 O 2 与水反应有 H 2 O 2 生成,故 A 正确;
B .由分析知, ②步骤 ii 中得到的氢氧化钠溶液浓度为 1mol/L ,与 ③ i 中氢氧化钠的浓度相等,因此现象都是滴加酚酞后,溶液变红色, 10 分钟后溶液褪色, ii 中滴加几滴盐酸后,氢氧化钠浓度减小,溶液变成红色,由 ④知, 0.1mol/L 的氢氧化钠溶液中滴加酚酞,溶液变红色, 2 小时后无明显变化,说明氢氧化钠溶液的浓度较大时,一段时间后颜色会褪去,浓度较小时,不能褪色,说明 ②溶液红色褪去是因为 c (OH - ) 大,故 B 正确;
C .根据 B 的分析可知, 1mol/L 的氢氧化钠溶液中滴加酚酞,溶液变红色,溶液褪色需要 10 分钟,而 ①中溶液变红色, 20 秒后就褪色,说明溶液红色褪去的主要原因不是 c ( OH - ) 大,而是过氧化氢的氧化作用,故 C 正确;
D . ①中过氧化氢已经将酚酞氧化了,因此褪色后的溶液再滴加 5 滴 6 mol/L 盐酸,溶液不能变成红色,故 D 错误;
故选 D 。

 ,故钠的金属性比较强,是很活泼的金属材料。其单质很软,具有银白色金属光泽,是热和电的良导体。钠的密度比水小,比煤油大,熔点97.81℃,沸点882.9℃。
,故钠的金属性比较强,是很活泼的金属材料。其单质很软,具有银白色金属光泽,是热和电的良导体。钠的密度比水小,比煤油大,熔点97.81℃,沸点882.9℃。 (白色固体,不稳定)(空气中,钠的切面由银白色逐渐变暗的原因)
(白色固体,不稳定)(空气中,钠的切面由银白色逐渐变暗的原因) (淡黄色固体,较稳定)
(淡黄色固体,较稳定)


 Ti+4NaCl
Ti+4NaCl