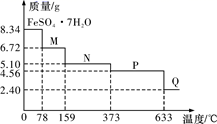
一水硫酸四氨合铜 (Cu(NH 3 ) 4 SO 4 ·H 2 O , M=246 g·mol -1 ) 是一种重要的染料,学习小组在实验室用 CuO 为主要原料合成该物质并进行含量分析。
已知: ① [Cu(NH 3 ) 4 ]SO 4 ·H 2 O=[Cu(NH 3 ) 4 ] 2+ +SO +H 2 O ; [Cu(NH 3 ) 4 ] 2+
Cu 2+ +4NH 3 。
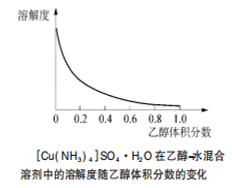
② (NH 4 ) 2 SO 4 在水中可溶,在乙醇中难溶; ③ Cu(NH 3 ) 4 SO 4 ·H 2 O 在乙醇 - 水混合溶剂中溶解度随乙醇体积分数变化曲线如图所示。
Ⅰ.一水硫酸四氨合铜的合成:
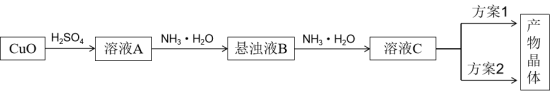
( 1 ) 方案 1 的实验步骤为:加热蒸发 → 冷却结晶 → 抽滤 → 洗涤 → 干燥。下列说法不正确的是 __ 。
A . 实验前研磨 CuO 固体以提高浸出率
B . 悬浊液 B 到溶液 C 的过程可以用离子方程式表示为: Cu(OH) 2 +4NH 3 ·H 2 O=[Cu(NH 3 ) 4 ] 2+ +2OH - +4H 2 O
C . 该方案得到的晶体中存在主要杂质为 (NH 4 ) 2 SO 4 或 CuSO 4
D . 得到的晶体可以采用自然风干或者烘干
( 2 ) 为了改进方案 1 ,减少杂质,方案 2 的实验步骤为:向 C 溶液中加入适量 → 抽滤 → 洗涤 → 干燥。
①在上述空格内填写合适的试剂 __ 。
②下列选项中,最适合作为洗涤剂的是 __ 。
A .乙醇 B .冷水 C . 95% 酒精溶液 D .滤液
③如图装置,经过一系列操作完成抽滤和洗涤。请选择合适的编号,按正确的操作顺序补充完整 ( 洗涤操作只需考虑一次 ) :
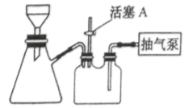
开抽气泵 →a→b→d→ __ →c→ 关抽气泵
a .转移固液混合物; b .关活塞 A ; c .开活塞 A ; d .确认抽干; e .加洗涤剂洗涤。
Ⅱ.间接碘量法测定产品中铜离子含量:
某小组制得的一水硫酸四氨合铜中可能含有少量 Fe( Ⅲ ) ,用间接碘量法测定一水硫酸四氨合铜中 Cu( Ⅱ ) 。
已知: ①在酸性溶液中, Cu 2+ 与过量 I - 作用,生成 I 2 和 CuI( 不溶于水也不溶于非氧化性酸 ) ,生成的 I 2 用 Na 2 S 2 O 3 标准溶液滴定 ( 滴定反应为: I 2 +2S 2 O =S 4 O
+2I - ) 。
② Fe 3+ +6F - =FeF ( 无色络合物 )
③微粒的氧化性强弱顺序: Fe 3+ > Cu 2+ > I 2 > FeF
( 3 ) 现准确称取 a g 产品,置于 250 mL 碘量瓶 ( 带磨口塞的锥形瓶 ) 中,加 50 mL 蒸馏水,适量 3 mol/L 稀硫酸,并加入少量 NaF 溶液,再加入足量 KI 溶液,摇匀,盖上碘量瓶瓶盖后,置于暗处 5 min ,充分反应后,加入 1 ~ 2 mL0.5% 淀粉溶液,用 c mol∙L -1 Na 2 S 2 O 3 标准溶液滴定至终点,共用去 V mL 标准液,产品的纯度为 __ ( 用含字母 c 、 V 的表达式表示 ) 。若滴定前不加入 NaF 溶液,有可能导致测量结果 __ ( 填 “ 偏高、偏低或不变 ”) 。
答案
( 1 ) CD
( 2 ) 乙醇 C cebd
( 3 ) ×100% 偏大
【分析】
Ⅰ. CuO 与 H 2 SO 4 反应产生溶液 A 是 CuSO 4 溶液,向其中加入 NH 3 ·H 2 O 发生复分解反应产生悬浊液 B 是 Cu(OH) 2 沉淀,继续向悬浊液中 NH 3 ·H 2 O , Cu(OH) 2 沉淀被过量 NH 3 ·H 2 O 溶解得到 [Cu(NH 3 ) 4 ](OH) 2 ,使溶液变为深蓝色,然后向其中加入乙醇,就析出深蓝色晶体 Cu(NH 3 ) 4 SO 4 ·H 2 O 。
Ⅱ.利用方程式得到关系式,然后根据物质反应转化关系先计算 Cu 2+ 的物质的量,再根据元素守恒及物质的含量计算方法计算产品的纯度。
( 1 )
A .实验前研磨 CuO 固体,可以使反应物接触面积增大,以提高固体物质的浸出率, A 正确;
B .悬浊液 B 到溶液 C 的过程是 Cu(OH) 2 被过量 NH 3 ·H 2 O 溶解,得到可溶性 [Cu(NH 3 ) 4 ](OH) 2 ,,用离子方程式表示为: Cu(OH) 2 +4NH 3 ·H 2 O=[Cu(NH 3 ) 4 ] 2+ +2OH - +4H 2 O , B 正确;
C .该方案在加热蒸发过程中 NH 3 挥发,使反应 [Cu(NH 3 ) 4 ] 2+ Cu 2+ +4NH 3 的平衡往右移动,且 Cu 2+ 会发生水解反应产生 Cu(OH) 2 或 Cu 2 (OH) 2 SO 4 ,故得到的晶体中存在主要杂质为 Cu(OH) 2 或 Cu 2 (OH) 2 SO 4 , C 错误;
D .含结晶水的晶体加热易失水,不宜采用直接加热烘干的方法,而应该选择采用自然风干, D 错误;
故合理选项是 CD ;
( 2 )
①根据图像分析, Cu(NH 3 ) 4 SO 4 ·H 2 O 在乙醇 · 水混合溶剂中的溶解度随乙醇体积分数的增大而减小,为了减少 Cu(NH 3 ) 4 SO 4 ·H 2 O 的损失,应加入 95% 乙醇溶液,以降低其溶解度,然后经 → 抽滤 → 洗涤 → 干燥,就得到纯净 Cu(NH 3 ) 4 SO 4 ·H 2 O ;
②根据 Cu(NH 3 ) 4 SO 4 ·H 2 O 在乙醇 · 水混合溶剂中的溶解度随乙醇体积分数的变化曲线示意图可知:随着乙醇的体积分数的增大, Cu(NH 3 ) 4 SO 4 ·H 2 O 的溶解度降低,为了减少 Cu(NH 3 ) 4 SO 4 ·H 2 O 的损失,应该降低 Cu(NH 3 ) 4 SO 4 ·H 2 O 的溶解度,故应该选用乙醇和水的混合液,故合理选项是 C ;
③经过一系列操作完成抽滤和洗涤,操作步骤为开抽气泵 →a→b→d→c→e→b→d→c→ 关抽气泵;
( 3 )
Cu 2+ 与过量 I - 作用,生成 I 2 和 CuI ,反应的离子方程式为: 2Cu 2+ +4I - =I 2 +2CuI↓ ,然后发生反应: I 2 +2S 2 O =S 4 O
+2I - ,则可得关系式: 2Cu 2+ ~ I 2 ~ 2S 2 O
, n (Cu 2+ )= n (S 2 O
)=cV×10 -3 mol ,则 Cu(NH 3 ) 4 SO 4 ·H 2 O 的含量为
;
若滴定前不加入 NaF 溶液,部分 Fe 3+ 也会与 S 2 O 发生反应,导致消耗的 Na 2 S 2 O 3 标准溶液体积偏大,以此为标准计算的 Cu 2+ 的物质的量就偏多,故最终导致测量结果偏大。



 N2+3Cu+3H2O
N2+3Cu+3H2O