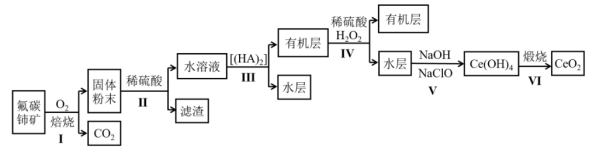
稀土是一种重要的战略资源,我国稀土出口量世界第一。铈 (Ce) 是一种典型的稀土元素,其在自然界中主要以氟碳铈矿 ( 主要成分为 CeCO 3 F) 形式存在。工业上利用氟碳铈矿制取 CeO 2 的一种工艺流程如图:
资料: ①铈 (Ce) 常见的化合价为 +3 和 +4 ;
②在 O 2 作用下,氟碳铈矿焙烧后的产物中有 CeO 2 和 CeF 4 ;
③在硫酸体系中, Ce 4+ 在 [(HA) 2 ] 中的溶解度大于其在水中的溶解度, Ce 3+ 与之相反。
回答下列问题:
( 1 ) 步骤 Ⅰ “ 焙烧 ” 过程中 CeCO 3 F 发生反应的化学方程式为 ____ 。
( 2 ) 步骤 Ⅱ充分反应后经过滤,得到的水溶液中阳离子有 ____ 。
( 3 ) 步骤 Ⅲ的操作名称是 ____ 。
( 4 ) 步骤 Ⅳ中加入 H 2 O 2 的目的是 ____ 。
( 5 ) 步骤 Ⅴ中发生反应的离子方程式是 ____ 。
( 6 ) 取上述流程中得到的 CeO 2 产品 加硫酸溶解,可与 50.0mL0.1mol/LFeSO 4 溶液恰好完全反应 ( 铈元素被还原为 Ce 3+ ,其他杂质均不参与反应 ) ,该产品中 CeO 2 的质量分数为 ____ 。 ( 已知: CeO 2 的摩尔质量为 172g/mol)
答案
( 1 )
( 2 ) Ce 4+ 和 Ce 3+
( 3 ) 分液
( 4 ) 作为还原剂
( 5 )
( 6 ) 86%
【分析】
根据流程通入氧气焙烧 CeCO 3 F 焙烧后的产物中有 CeO 2 、 CeF 4 和 CO 2 ,稀硫酸酸浸 CeO 2 、 CeF 4 等固体溶解,溶液中存在 Ce 4+ 和 Ce 3+ ,已知 Ce 4+ 在 [(HA) 2 ] 中的溶解度大于其在水中的溶解度,可以萃取出 Ce 4+ ,用稀硫酸和 H 2 O 2 反萃取, Ce 4+ 转化为 Ce 3+ , Ce 3+ 与氢氧化钠和次氯酸钠反应生成 Ce(OH) 4 ,煅烧产生 CeO 2 。
( 1 )
根据题给信息知, “ 通人 O 2 焙烧 ” 过程中 CeCO 3 F 根据题给信息知, “ 通人 O 2 焙烧 ” 过程中 CeCO 3 F 发生反应的化学方程式为 ,故答案为:
。
( 2 )
稀硫酸酸浸 CeO 2 、 CeF 4 等固体溶解,溶液中存在 Ce 4+ 和 Ce 3+ ,故得到的水溶液中阳离子有 Ce 4+ 和 Ce 3+ ,故答案为: Ce 4+ 和 Ce 3+
( 3 )
Ce 4+ 在 [(HA) 2 ] 中的溶解度大于其在水中的溶解度,可以萃取出 Ce 4+ ,经过分液可以分离出水层和有几层,该操作为分液,故答案为:分液。
( 4 )
“ 反萃取 ” 过程在稀硫酸和 H 2 O 2 参与反应, H 2 O 2 作为还原剂、 Ce 4+ 作为氧化剂,生成 Ce 3+ ,故答案为: 作 为还原剂。
( 5 )
Ce 3+ 在氢氧化钠环境下被次氯酸钠氧化生成 Ce(OH) 4 ,离子方程式为: ,故答案为:
。
( 6 )
CeO 2 产品 加硫酸溶解,可与 50.0mL0.1mol/LFeSO 4 溶液恰好完全反应,发生离子方程式为:
,由此可知
=
,该产品中 CeO 2 的质量分数为
,故答案为: 86% 。



