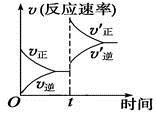
反应 2A(g) 2Y(g) + E(g)ΔH>0 达到平衡时,要使正反应速率降低, A 的浓度增大,应采取的措施是( )
A . 加压 B . 减压 C . 减小 E 的浓度 D . 降温
答案
D
【分析】
达平衡时,要使 v 正 降低,可采取降低温度、减小压强或减小浓度的措施,使 c ( A )增大,应使平衡向逆反应方向移动,据此结合选项分析解答。
【详解】
A 、增大压强,平衡向逆反应方向移动, A 的浓度增大,但正、逆反应速率都增大,故 A 错误;
B 、降低压强,正、逆速率都减小,平衡向正反应方向移动, A 的浓度降低,故 B 错误;
C 、减小 E 的浓度,平衡向正向反应方向移动, A 的浓度减小,正逆反应速率减小,故 C 错误;
D 、正反应为吸热反应,降低温度,平衡逆反应方向移动,正、逆反应速率都减小, A 的浓度增大,故 D 正确。
故选 D 。