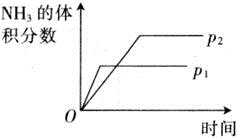
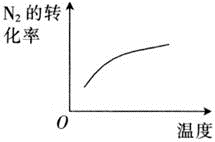
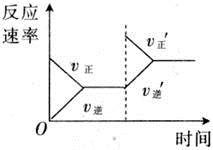
对于可逆反应 N 2 (g) + 3H 2 (g) 2NH 3 (g) △ H <0 下列研究的目的和图示相符的是
| 选项 | A | B |
| 研究目的 | 压强对反应的影响 | 温度对反应的影响 |
| 图示 | | |
| 选项 | C | D |
| 研究目的 | 平衡体系增加 | 催化剂对反应的影响 |
| 图示 | | |
A . A B . B C . C D . D
答案
C
【详解】
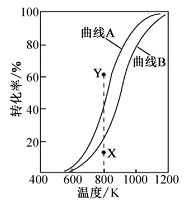
A .从图示可以看出, p 1 压强下反应先达到平衡,所以 p 1 > p 2 。该反应的正反应是体积减小的反应,压强增大,平衡正向移动, NH 3 的体积分数应增大,图示和实际不符;
B .该反应的正反应是放热反应,升高温度,平衡逆向移动, N 2 的转化率应降低,图示和实际不符;
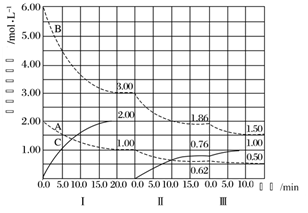
C .增加 N 2 ,反应物浓度增大,正反应速率加快,逆反应速率暂时不变,随之增大,平衡正向移动,图示和实际相符;
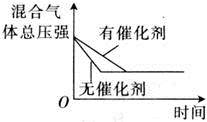
D .催化剂能加快反应速率,缩短到达平衡所需的时间,图示和实际不符;
故选 C 。

 pC(g)+qD(g)
pC(g)+qD(g)  。
。 时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。
时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。 指的是同一物质的正反应速率与逆反应速率相等。
指的是同一物质的正反应速率与逆反应速率相等。  qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。
qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。