下列实验操作、现象及结论正确的是
| 选项 | 实验 | 操作、现象及结论 |
| A | 鉴别 NaHCO 3 与 Na 2 CO 3 | 取少许两种物质,加入几滴水,插入温度计,温度降低的是 Na 2 CO 3 |
| B | 探究 Na 2 O 2 与水反应 | 将 2mL 水滴入盛有 1g 过氧化钠试管中,立即把带火星木条伸入试管,木条复燃,证明有氧气产生 |
| C | 检验 Fe 3+ 中是否含 Fe 2+ | 向溶液中加入 KSCN 溶液,变红则含 Fe 2+ |
| D | 检验溶液中是否含 SO | 向某溶液中加入盐酸酸化的 BaCl 2 溶液,有白色沉淀,说明含有 SO |
A . A B . B C . C D . D
答案
B
【详解】
A . Na 2 CO 3 中滴入水,形成十水合碳酸钠,放热,取少许两种物质,加入几滴水,插入温度计,温度升高的是 Na 2 CO 3 ,故 A 错误;
B .将 2mL 水滴入盛有 1g 过氧化钠试管中,立即把带火星木条伸入试管,木条复燃,证明过氧化钠与水反应有氧气产生,故 B 正确;
C .向溶液中加入 KSCN 溶液,变红说明含 Fe 3+ ,不能证明含有 Fe 2+ ,故 C 错误;
D .检验溶液中是否含 SO 时,向某溶液中加入盐酸酸化的 BaCl 2 溶液,有白色沉淀,该沉淀可能是 AgCl 也可能是 BaSO 4 ,不能说明含有 SO
,故 D 错误;
答案选 B 。


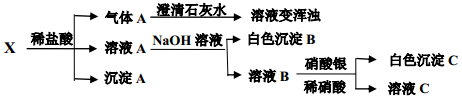
 的检验:
的检验: ,
, 具有不溶于盐酸、硝酸的特性。
具有不溶于盐酸、硝酸的特性。 溶液或
溶液或 溶液,盐酸和稀硝酸。
溶液,盐酸和稀硝酸。  、
、 等判成SO42-,此时上述离子会分别产生
等判成SO42-,此时上述离子会分别产生 等白色沉淀.
等白色沉淀. 等判成SO42-,如向待测液中先滴加
等判成SO42-,如向待测液中先滴加 溶液,再加盐酸有白色沉淀生成便断定含SO42-。其错误之处是未注意溶液中不含SO42-而含Ag+或
溶液,再加盐酸有白色沉淀生成便断定含SO42-。其错误之处是未注意溶液中不含SO42-而含Ag+或 也会有同样现象,因为
也会有同样现象,因为

 判成
判成 ,如向待测液中滴加盐酸酸化的
,如向待测液中滴加盐酸酸化的 溶液,或滴加硝酸酸化的
溶液,或滴加硝酸酸化的 ,错在未注意
,错在未注意 在酸性条件下具有强氧化性,可将
在酸性条件下具有强氧化性,可将
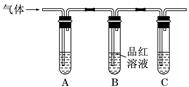
 的检验常用气体法:
的检验常用气体法: (不能用硝酸等强氧化性酸),生成能使品红溶液褪色的无色有刺激性气味的气体。
(不能用硝酸等强氧化性酸),生成能使品红溶液褪色的无色有刺激性气味的气体。  的检验
的检验  ,所用酸必须是非强氧化性酸,可用稀盐酸或稀硫酸,生成能使湿润的醋酸铅试纸变黑的气体。
,所用酸必须是非强氧化性酸,可用稀盐酸或稀硫酸,生成能使湿润的醋酸铅试纸变黑的气体。  ,生成黑色沉淀;或
,生成黑色沉淀;或 ,生成乳白色或黄色沉淀(溶液中)。
,生成乳白色或黄色沉淀(溶液中)。 ”表示。
”表示。 





 。
。 。
。  等亚硫酸盐易溶于水、易电离。
等亚硫酸盐易溶于水、易电离。