下列说法正确的是
A . 和
互为同位素 B . 质子数为 6 ,中子数为 8 的微粒:
C . NaClO 的电子式: ![]() D .
D . 结构式:
答案
C
【详解】
A .质子数相同,中子数不同的同一元素的不同原子互称同位素,同位素的研究对象是原子, 和
都是氧元素组成的不同单质,互为同素异形体,故 A 不符合题意;
B .元素符号左下角的数字代表质子数,左上角的数字代表质量数,质子数为 6 ,中子数为 8 的碳原子的质量数为 6+8=14 ,微粒表示为: ,故 B 不符合题意;
C . NaClO 中钠离子和次氯酸根离子间形成离子键,次氯酸根中氧原子在中间,得到钠原子给一个电子,和氯原子共用一对共用电子对, NaClO 的电子式 ![]() ,故 C 符合题意;
,故 C 符合题意;
D .碳原子的最外层电子数为 4 ,氧原子的最外层电子数为 6 ,要达到稳定结构, 中碳原子和两个氧原子分别形成两对共价键,结构式: O=C=O ,故 D 不符合题意;
答案选 C 。


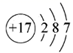 D
D