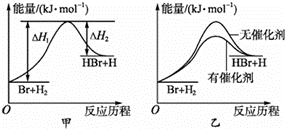
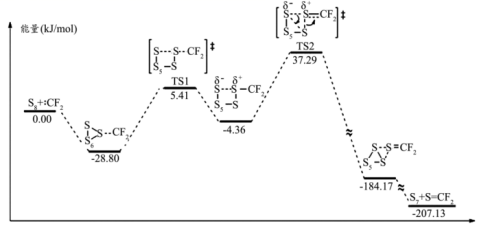
二氟卡宾 ( : CF 2 ) 作为一种活性中间体,一直受到有机氟化学研究工作者的高度关注。硫单质与二氟卡宾可以形成 S=CF 2 ,反应历程如图所示:
下列叙述错误的是
A . S 8 和: CF 2 生 S=CF 2 成反应的 ΔH=-207.13kJ/mol
B . 由 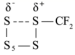 生成
生成 ![]() 的活化能为 34.21kJ/mol
的活化能为 34.21kJ/mol
C . 上述反应历程中存在 S-S 键的断裂和生成
D . 决定反应速率的基元反应的活化能为 41.65kJ/mol
答案
B
【详解】
A .由图像可知反应物 1mol(S 8 + : CF 2 ) 所具有的能量看为 0 ,生成物 1mol(S7+S=CF2) 所具有的能量为 -207.13kJ ,所以 S8 和 :CF2 生成 S=CF2 反应的 ΔH=-207.13kJ/mol ,故 A 正确;
B . 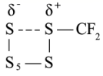 所具有的能量高于
所具有的能量高于 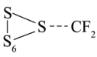 所具有的能量,所以活化能为
所具有的能量,所以活化能为 ,即活化能为 41.65kJ/mol ,故 B 错误;
C .由 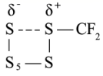 生成
生成 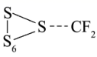 既有 S-S 键的断裂又有 S-S 键的生成,故 C 正确;
既有 S-S 键的断裂又有 S-S 键的生成,故 C 正确;
D .第二步反应的活化能大,反应慢,决定了反应的速率。所以决定反应速率的基元反应的活化能为 41.65kJ/mol ,故 D 正确;
答案选 B 。