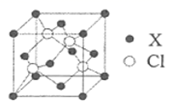
硅、锗 (Ge) 及其化合物广泛应用于光电材料领域。回答下列问题:
(1) 基态硅原子最外层的电子排布图为 _______ ,晶体硅和碳化硅熔点较高的是 _______ ( 填化学式 ) ;
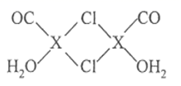
(2) 硅和卤素单质反应可以得到 ,
的熔沸点如下表:
| | | | | |
| 熔点 /K | 183.0 | 203.2 | 278.6 | 393.7 |
| 沸点 /K | 187.2 | 330.8 | 427.2 | 560.7 |
① 0 ℃时, 、
、
、
呈液态的是 ____ ( 填化学式 ) ,沸点依次升高的原因是 _____ ,气态
分子的空间构型是 _______ ;
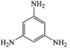
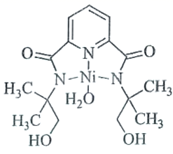
② 与 N- 甲基咪唑
![]() 反应可以得到
反应可以得到 ,其结构如图所示:
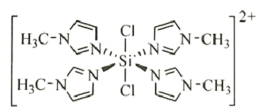
N- 甲基咪唑分子中碳原子的杂化轨道类型为 _______ , H 、 C 、 N 的电负性由大到小的顺序为 _______ , 1 个 中含有 _______ 个
键;
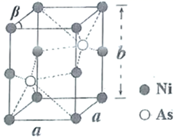
(3) 下图是 、
、
三种元素形成的某化合物的晶胞示意图。
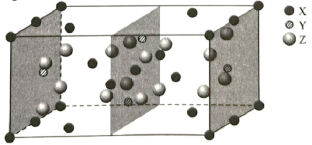
①己知化合物中 和
的原子个数比为 1 : 4 ,图中 Z 表示 _______ 原子 ( 填元素符号 ) ,该化合物的化学式为 _______ ;
②已知该晶胞的晶胞参数分别为 anm 、 bnm 、 cnm , ,则该晶体的密度
_______
( 设阿伏加德罗常数的值为
,用含 a 、 b 、 c 、
的代数式表示 ) 。
答案
![]() ; SiC SiCl 4 SiX 4 都是结构相似的分子晶体,相对分子质量依次增大,分子间作用力依次增大 正四面体形 sp 2 、 sp 3 ;; N>C>H 54 O Mg 2 GeO 4 =
; SiC SiCl 4 SiX 4 都是结构相似的分子晶体,相对分子质量依次增大,分子间作用力依次增大 正四面体形 sp 2 、 sp 3 ;; N>C>H 54 O Mg 2 GeO 4 = ×10 21
【详解】
(1) 硅元素的原子序数为 14 ,价电子排布式为 3s 2 3p 2 ,则价电子排布图为 ![]() ;原子晶体的熔点取决于共价键的强弱,晶体硅和碳化硅都是原子晶体,碳原子的原子半径小于硅原子,非金属性强于硅原子,碳硅键的键能大于硅硅键、键长小于硅硅键,则碳硅键强于硅硅键,碳化硅的熔点高于晶体硅,故答案为:
;原子晶体的熔点取决于共价键的强弱,晶体硅和碳化硅都是原子晶体,碳原子的原子半径小于硅原子,非金属性强于硅原子,碳硅键的键能大于硅硅键、键长小于硅硅键,则碳硅键强于硅硅键,碳化硅的熔点高于晶体硅,故答案为: ![]() ; SiC ;
; SiC ;
(2) ①由题给熔沸点数据可知, 0 ℃时,四氟化硅为气态,四氯化硅为液态,四溴化硅、四碘化硅为固态;分子晶体的沸点取决于分子间作用力的大小, SiX 4 都是结构相似的分子晶体,相对分子质量依次增大,分子间作用力依次增大,则 SiX 4 的沸点依次升高; SiX 4 分子中硅原子的价层电子对数为 4 ,孤对电子对数为 0 ,则分子的空间构型为正四面体形,故答案为: SiCl 4 ; SiX 4 都是结构相似的分子晶体,相对分子质量依次增大,分子间作用力依次增大;正四面体形;
②由 M 2+ 离子的结构可知,离子中含有杂化方式为 sp 3 杂化的单键碳原子和 sp 2 杂化的双键碳原子;元素的非金属性越强,其电负性越大,元素的非极性强弱顺序为 N>C>H ,则元素电负性的大小顺序为 N>C>H ; M 2+ 离子的结构中含有单键、双键和配位键,单键和配位键都是 σ 键,双键中含有 1 个 σ 键,则离子中含有 54 个 σ 键,故答案为: sp 2 、 sp 3 ; N>C>H ; 54 ;
(3) ①由晶胞结构可知,晶胞中位于顶点、面心、棱上和体内的 X 原子为 8× +6×
+4×
+3=8 ,位于体内的 Y 原子和 Z 原子分别为 4 和 16 ,由 Ge 和 O 原子的个数比为 1 : 4 可知, X 为 Mg 原子、 Y 为 Ge 原子、 Z 为 O 原子,则晶胞的化学式为 Mg 2 GeO 4 ,故答案为: O ; Mg 2 GeO 4 ;
②由晶胞的质量公式可得: =abc×10 —21 ×ρ ,解得 ρ=
×10 21 g/cm 3 ,故答案为:
×10 21 。