无水 MgBr 2 可用作催化剂.实验室采用镁屑与液溴为原料制备无水 MgBr 2 ,装置如图所示 ( 夹持仪器略去 ) .主要步骤如下 :
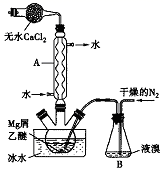
步骤 l: 三颈瓶中装入 10g 镁屑和 150mL 无水乙醚,装置 B 中加入适量的液溴.
步骤 2: 缓慢通入干燥的氮气,直至溴完全导入三颈瓶中.
步骤 3: 反应完毕后恢复至室温,过滤,将滤液转移至另一干燥的烧瓶中,冷却至 0℃ ,析出晶体,再过滤得三乙醚合溴化镁粗品
步骤 4: 常温下用苯溶解粗品,冷却至 0℃ ,析出晶体,过滤,洗涤得三乙醚合溴化镁,加热至 160℃ 分解得无水 MgBr 2 产品.
已知 :
① 乙醚是一种有机物,为无色透明液体,极易挥发,化学性质比较稳定;
②Mg 和 Br 2 反应剧烈放热; MgBr 2 具有强吸水性.;
③MgBr 2 +3C 2 H 5 OC 2 H 5 ⇌ MgBr 2 ·3C 2 H 5 OC 2 H 5 ( 三乙醚合溴化镁 )
请回答 :
(1) 仪器 A 的名称是 ___________ ,它在实验中的作用是 ____________ .
(2) 实验中不能用干燥的空气代替干燥 N 2 ,原因是: ______________________
(3) 步骡 2 中,可以将 B 装置中的溴完全导入三颈瓶中的原因是 _______________ ;该实验如果将所用液溴一次性全部加入三颈瓶中,其后果是 ____________________ .
(4) 步骡 3 中,第一次过滤得到的固体物质是 _____ ;
(5) 有关步骤 4 的说法正确的是 ________________
A .可用 95% 的乙醇代替苯溶解粗品 B .洗涤晶体可选用 0℃ 的苯
C .加热不的主要目的是除去笨 D .该步骤的目的是除去乙醚和可能残留的溴
答案
球形冷凝管 使挥发的乙醚和溴蒸气冷却并回流至反应装置 镁屑与氧气反应,生成的 MgO 阻碍镁与溴反应 氮气的气流促进溴的挥发 反应过于剧烈,使反应过程难以控制 镁 AD
【分析】
Mg+Br 2 =MgBr 2 的反应比较剧烈, MgBr 2 具有很强的吸水性,反应中用盛无水 CaCl 2 的干燥管,防止水蒸气进入, Br 2 挥发性强,氧化性强,反应中用球形冷凝管不断冷凝,让它与 Mg 充分接触。
【详解】
(1) 仪器 A 的名称是球形冷凝管,它在实验中的作用是使挥发出的乙醚和溴蒸气冷却并回流至反应装置,提高溴的反应率;
(2) 0℃ 时,镁与氮气不反应,若换为空气,则镁与空气中的氧气反应,降低三乙醚合溴化镁的产量;
(3) 液溴具有挥发性,干燥的氮气流促进液溴不断地挥发,慢慢进入三颈瓶中与镁反应;如果将所用液溴一次性全部加入三颈瓶中,镁与溴反应过于激烈,放出大量热,反应难以控制;
(4) 步骡 3 中,第一次过滤得到的固体物质是未反应的镁;
(5)A . 95% 的乙醇含有水, MgBr 2 能与水反应,则不能用 95% 的乙醇代替苯溶解粗品, A 说法错误;
B .洗涤晶体可选用 0℃ 的苯,可减少产品的溶解, B 说法正确;
C .加热的主要目的使 MgBr 2 ·3C 2 H 5 OC 2 H 5 分解,制备无水 MgBr 2 , C 说法错误;
D .溴易溶于有机溶剂,则该步骤的目的是除去乙醚和可能残留的溴, D 说法正确;
答案为 AD 。

 (纯氧中发出耀眼的白光)
(纯氧中发出耀眼的白光) (Al2S3在溶液中完全双水解)
(Al2S3在溶液中完全双水解)
 (AlN与水反应生成Al(OH)3和NH3↑)
(AlN与水反应生成Al(OH)3和NH3↑) 




 ,
, ,所以根据得失电子守恒可知:
,所以根据得失电子守恒可知: ,利用此关系可以方便地进行有关计算。
,利用此关系可以方便地进行有关计算。