二氧化氯是一种黄绿色具有刺激性气味的气体,常用于自来水消毒和果蔬保鲜等方面。氯酸钠还原法是目前使用较为广泛的![]() 制备方法,其中是用
制备方法,其中是用![]() 与
与![]() 在催化剂、
在催化剂、![]() 时,发生反应得到
时,发生反应得到![]() ,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。
,下图装置(夹持装置略)对其制备、吸收、释放进行了研究。
已知:
①![]() 的浓度较大时易分解,实验室用稳定剂吸收
的浓度较大时易分解,实验室用稳定剂吸收![]() ,生成
,生成![]() ,使用时加酸只释放出
,使用时加酸只释放出![]() 一种气体
一种气体
②![]() 与KI反应的离子方程式为:
与KI反应的离子方程式为:![]() 。
。
| 物质 |
|
|
|
| 沸点 |
|
|
|
③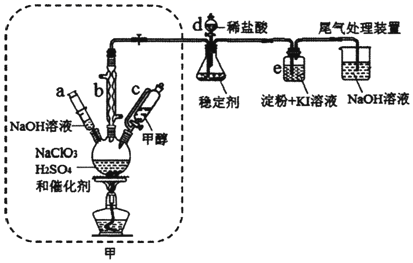
(1)仪器b在装置中的作用是______________;比较仪器c和d,实验中c的优点是_____________。
(2)制备装置甲中需改进的一项措施是________________。
(3)反应中甲醇被氧化为甲酸,写出制备![]() 的化学方程式:________________;该制备法可选用不同的还原性物质作为还原剂,例如草酸,相比甲醇法,草酸法的优点是________________。
的化学方程式:________________;该制备法可选用不同的还原性物质作为还原剂,例如草酸,相比甲醇法,草酸法的优点是________________。
(4)下列有关说法正确的是__________。
A.仪器a中NaOH溶液主要用于停止反应,并吸收多余的![]()
B.装置e主要用于检验是否有![]() 生成
生成
C.在![]() 释放实验中,发生的离子反应方程式是:
释放实验中,发生的离子反应方程式是:![]()
D.![]() 和
和![]() 都为强氧化剂,在相同条件下,等物质的量时
都为强氧化剂,在相同条件下,等物质的量时![]() 的氧化能力是
的氧化能力是![]() 的2.5倍
的2.5倍
(5)自来水厂用碘量法检测水中![]() 的浓度,其实验操作如下:取100.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用
的浓度,其实验操作如下:取100.0mL的水样,加入足量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液。再用![]() 标准溶液滴定碘单质
标准溶液滴定碘单质![]() ,达到滴定终点时用去15.00mL
,达到滴定终点时用去15.00mL ![]() 标准溶液,测得该水样中
标准溶液,测得该水样中![]() 的含量为__________
的含量为__________![]() 。
。
答案
冷凝回流甲醇兼导气 有利于液体顺利流下,减少甲醇的挥发 水浴加热 4NaClO3+CH3OH+2H2SO4![]() 4ClO2↑+HCOOH+2Na2SO4+3H2O 产生的二氧化碳可稀释ClO2,防止ClO2浓度较大时分解 AC 202.5
4ClO2↑+HCOOH+2Na2SO4+3H2O 产生的二氧化碳可稀释ClO2,防止ClO2浓度较大时分解 AC 202.5
【分析】
甲装置为发生装置,将甲醇加入三颈烧瓶中共热进行反应,甲醇被氧化为甲酸,NaClO3还原生成ClO2,在硫酸条件下,还生成硫酸钠,b装置冷凝回流甲醇和甲酸;加入a装置的氢氧化钠可以中和酸,使反应停止,并吸收ClO2;之后稳定剂吸收二氧化氯,装置e主要用于检验ClO2否被吸收完全,之后用氢氧化钠溶液处理尾气。据此解答。
【详解】
(1)仪器b是球形冷凝管,导气的同时可以冷凝回流甲醇;若用分液漏斗添加甲醇,反应时三颈烧瓶中压强增大,可能会导致液体无法顺利滴下,需要将分液漏斗活塞打开,但会导致甲醇的挥发,用恒压漏斗可以平衡压强有利于液体顺利流下,减少甲醇的挥发,故答案为:冷凝回流甲醇兼导气;有利于液体顺利流下,减少甲醇的挥发;
(2)反应在60℃下进行,应水浴加热,可提供稳定的加热温度,故答案为:水浴加热;
(3)甲醇被氧化为甲酸(HCOOH),NaClO3还原生成ClO2,在硫酸条件下,还生成硫酸钠,反应方程式为:4NaClO3+CH3OH+2H2SO4![]() 4ClO2↑+HCOOH+2Na2SO4+3H2O,草酸可被氧化生成二氧化碳,起到稀释的作用,避免ClO2的浓度较大时易分解,故答案为:4NaClO3+CH3OH+2H2SO4
4ClO2↑+HCOOH+2Na2SO4+3H2O,草酸可被氧化生成二氧化碳,起到稀释的作用,避免ClO2的浓度较大时易分解,故答案为:4NaClO3+CH3OH+2H2SO4![]() 4ClO2↑+HCOOH+2Na2SO4+3H2O;产生的二氧化碳可稀释ClO2,防止ClO2浓度较大时分解;
4ClO2↑+HCOOH+2Na2SO4+3H2O;产生的二氧化碳可稀释ClO2,防止ClO2浓度较大时分解;
(4)A.加入氢氧化钠可以中和酸,使反应停止,并吸收ClO2,故A正确;B.装置e主要用于检验ClO2否被吸收完全,故B错误;C.用稳定剂吸收ClO2,生成NaClO2,使用时加酸只释放出ClO2一种气体,则发生的离子反应方程式是:4H++5ClO2-=Cl-+4ClO2↑+2H2O,故C正确;D.ClO2和Cl2都为强氧化剂,在相同条件下,等物质的量时,元素化合价分别由+4价、0价降为-1价,则ClO2的氧化能力是Cl2的2.5倍,故D错误;故答案为:AC;
(5)设保鲜剂中ClO2的含量为x g•L-1,根据电子守恒可知二氧化氯与氧化碘离子生成的碘单质存在数量关系:2ClO2~5I2,滴定时碘单质与S2O32-存在数量关系I2~2S2O32-,所以ClO2与标准液的数量关系为2ClO2~10S2O32-,则有![]() ,解得x=0.2025 g•L-1=202.5 mg•L-1,故答案为:202.5。
,解得x=0.2025 g•L-1=202.5 mg•L-1,故答案为:202.5。



