为分离废磷酸亚铁锂电池的正极材料(主要含LiFePO4和铝箔)中的金属,将正极材料粉碎后进行如下流程所示的转化:
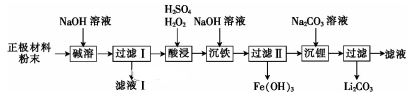
已知LiFePO4不溶于水和碱,能溶于强酸。
(1)“碱溶”时的离子方程式为___。
(2)向滤液Ⅰ中通入过量CO2会析出Al(OH)3沉淀,写出该反应的离子方程式:____。
(3)“酸浸”时溶液中Fe2+发生反应的离子方程式为_____。
(4)检验“沉铁”后所得溶液中是否存在Fe3+的方法是____。
(5)以Fe(OH)3为原料可以制取FeSO4晶体,还需的试剂有____。
(6)“沉锂”时,检验Li+是否沉淀完全的方法是____。
答案
2Al+2OH-+2H2O![]() 2AlO2-+3H2↑ AlO2-+2H2O+CO2
2AlO2-+3H2↑ AlO2-+2H2O+CO2![]() Al(OH)3↓+HCO3- 2Fe2++2H++H2O2
Al(OH)3↓+HCO3- 2Fe2++2H++H2O2![]() 2Fe3++2H2O 取少量沉铁后所得上层溶液,向其中滴加KSCN溶液,若溶液变红色,则存在Fe3+,若溶液不变红,则不存在Fe3+ 硫酸、铁粉 静置,向上层清液中继续滴加Na2CO3溶液,若无沉淀生成,则Li+沉淀完全
2Fe3++2H2O 取少量沉铁后所得上层溶液,向其中滴加KSCN溶液,若溶液变红色,则存在Fe3+,若溶液不变红,则不存在Fe3+ 硫酸、铁粉 静置,向上层清液中继续滴加Na2CO3溶液,若无沉淀生成,则Li+沉淀完全
【分析】
废磷酸亚铁锂电池的正极材料(主要含LiFePO4和铝箔),加入NaOH溶液,铝箔与NaOH溶液反应生成偏铝酸钠和水,所以滤液Ⅰ为NaAlO2,LiFePO4不溶于水和碱,所以滤渣Ⅰ为LiFePO4,LiFePO4能溶于强酸,加入H2SO4、H2O2,其中的Fe2+被氧化为Fe3+,加入NaOH溶液,生成Fe(OH)3沉淀,再加入Na2CO3溶液,Li+转化为Li2CO3沉淀,据此答题。
【详解】
(1)“碱溶”时,正极材料粉末中的铝箔与NaOH溶液反应生成偏铝酸钠和水,化学方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑,离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑,故答案为2Al+2OH-+2H2O=2AlO2-+3H2↑。
(2)滤液Ⅰ为NaAlO2溶液,通入过量CO2会生成Al(OH)3沉淀,反应的化学方程式为:AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-,故答案为AlO2-+2H2O+CO2=Al(OH)3↓+HCO3-。
(3)“酸浸”时溶液中的Fe2+在酸性条件下被H2O2氧化为Fe3+,反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O,故答案为2Fe2++2H++H2O2=2Fe3++2H2O。
(4)检验“沉铁”后所得溶液中是否存在Fe3+的方法是取少量沉铁后所得上层溶液,向其中滴加KSCN溶液,若溶液变红色,则存在Fe3+,若溶液不变红,则不存在Fe3+,故答案为取少量沉铁后所得上层溶液,向其中滴加KSCN溶液,若溶液变红色,则存在Fe3+,若溶液不变红,则不存在Fe3+。
(5)先将Fe(OH)3与H2SO4反应生成硫酸铁,硫酸铁与铁粉反应生成硫酸亚铁,故答案为硫酸、铁粉。
(6)“沉锂”时,检验Li+是否沉淀完全的方法是静置,向上层清液中继续滴加Na2CO3溶液,若无沉淀生成,则Li+沉淀完全,故答案为静置,向上层清液中继续滴加Na2CO3溶液,若无沉淀生成,则Li+沉淀完全。
