为测定含镁3%~5%的铝镁合金中镁的质量分数,设计了2种实验方案,下列说法不正确的是
方案一:镁铝合金加入足量的氢氧化钠溶液中充分反应后过滤,测定剩余固体质量;
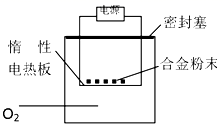
方案二:称量m g铝镁合金粉末,放在图中惰性电热板上,通电使其充分灼烧。测得固体质量增重。
A.方案一中若称取5.4 g合金粉末样品,投入V mL 2.0 mol/L NaOH溶液中反应,则V≥100 mL
B.方案一中测定剩余固体质量时,过滤后未洗涤固体就干燥、称量,则镁的质量分数偏高
C.方案二中欲计算镁的质量分数,实验中还需测定灼烧后固体的质量
D.方案二中若用空气代替O2进行实验,则测定结果偏高
答案
A
【解析】
A.含镁为5%时,金属铝的含量最低,5.4 g合金中铝的质量为5.13g;则根据反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑可知,2Al~2NaOH,5.13/27:V×10-3×2=2:2,解得V=95mL,因此取5.4 g合金粉末样品,投入V mL 2.0 mol/L NaOH溶液中反应,则V≥95 mL,A错误;
B. 方案一中金属铝与氢氧化钠溶液反应,过滤后剩余固体镁;测定剩余固体质量时,过滤后未洗涤固体就干燥、称量,相当于镁的质量偏大,则镁的质量分数偏高,B正确;
C.Mg、Al均与氧气反应,生成金属氧化物,则还需测定生成物的质量,根据质量守恒列方程可以求出金属镁的质量,进而求出镁的质量分数,C正确;
D. 空气中有氮气和氧气,金属镁能够与氮气反应生成氮化镁,灼烧后固体质量增大,金属镁的质量偏大,测定结果偏高,D正确;
综上所述,本题选A。



 N2+3Cu+3H2O
N2+3Cu+3H2O