实验室以绿矾(FeSO4·7H2O)制备补血剂甘氨酸亚铁[(NH2CH2COO)2Fe] 有关物质性质
| 甘氨酸(NH2CH2COOH) | 柠檬酸 | 甘氨酸亚铁 |
| 易溶于水,微溶于乙醇, 两性化合物 | 易溶于水和乙醇,有强酸性 和还原性 | 易溶于水, 难溶于乙醇 |
实验过程:Ⅰ.配制含0.10mol FeSO4的绿矾溶液。
Ⅱ.制备FeCO3:将配制好的绿矾溶液与200mL 1.1mol·L-1NH4HCO3溶液混合,反应结束后过滤并洗涤沉淀。
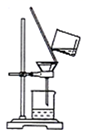
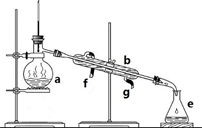
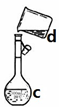
Ⅲ.制备(NH2CH2COO)2Fe:实验装置如下图(夹持和加热仪器已省略),将实验Ⅱ得到的沉淀和含0.20 mol甘氨酸的水溶液混合后加入C中,然后利用A中的反应将C中空气排净,接着滴入柠檬酸溶液并加热。反应结束后过滤,滤液经蒸发结晶、过滤、洗涤、干燥得到产品。回答下列问题:

(1)实验I中:实验室配制绿矾溶液,将铁粉与稀硫酸混合时哪种试剂应该过量_______
(2)实验II中:制备FeCO3时应向_______溶液中缓慢加入________溶液边加边搅拌,若颠倒试剂滴加顺序可能产生的后果是__________________生成沉淀的离子方程式为________________
(3)确认C中空气排尽的实验现象是______________
(4)加入柠檬酸溶液一方面可调节溶液的pH促进FeCO3溶解,另一个作用是___________
(5)洗涤实验Ⅲ中得到的沉淀,所选用的最佳洗涤试剂是___________________。(填序号)
A.热水 B.乙醇溶液 C.柠檬酸溶液
(6)若产品的质量为17.34g,则产率为________%。
答案
FeFeSO4NH4HCO3可能生成氢氧化亚铁沉淀Fe2++2HCO3-=FeCO3↓+CO2↑+ H2OD中澄清石灰水变浑浊防止二价铁被氧化B85
【解析】
(1). Fe2+易被空气中的O2氧化成Fe3+,实验室配制绿矾溶液时,为防止FeSO4被氧化变质,在制备过程中应铁粉过量, Fe3+可被铁粉还原为Fe2+;
(2). 向配制好的绿矾溶液中,缓慢加入200mL 1.1mol·L-1NH4HCO3溶液,边加边搅拌,反应结束后过滤并洗涤沉淀;若颠倒试剂滴加顺序,NH4HCO3溶液呈碱性,可能会产生氢氧化亚铁沉淀;生成沉淀的离子方程式为:Fe2++2HCO3-=FeCO3↓+CO2↑+ H2O;
(3). 当C中充满CO2后,CO2开始进入D中,使D中的澄清石灰水变浑浊,这时说明C中空气已经排尽;
(4).由题中信息可知,柠檬酸具有强还原性,可防止Fe2+被氧化;
(5). 因甘氨酸亚铁易溶于水,难溶于乙醇,所以应选择乙醇溶液作为洗涤剂,故答案为:B;
(6). 含0.10mol FeSO4的绿矾溶液中Fe2+的物质的量为0.10mol,因NH4HCO3溶液过量,所以生成(NH2CH2COO)2Fe的物质的量为0.10mol、质量为20.4g,则产率为:![]() ×100%=85%。
×100%=85%。