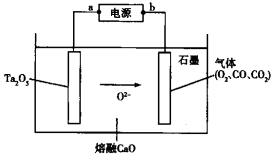
我国科学家研制了一种新型的高比能量锌-碘溴液流电池,其工作原理示意图如下。图中贮液器可储存电解质溶液,提高电池的容量。下列叙述不正确的是
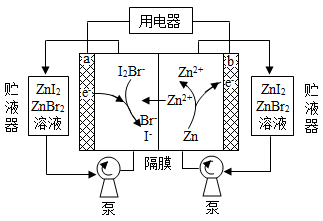
A.放电时,a电极反应为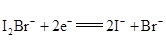
B.放电时,溶液中离子的数目增大
C.充电时,b电极每增重![]() ,溶液中有
,溶液中有![]() 被氧化
被氧化
D.充电时,a电极接外电源负极
答案
D
【分析】
放电时,Zn是负极,负极反应式为Zn-2e-═Zn2+,正极反应式为I2Br-+2e-=2I-+Br-,充电时,阳极反应式为Br-+2I--2e-=I2Br-、阴极反应式为Zn2++2e-=Zn,只有阳离子能穿过交换膜,阴离子不能穿过交换膜,据此分析解答。
【详解】
A、放电时,a电极为正极,碘得电子变成碘离子,正极反应式为I2Br-+2e-=2I-+Br-,故A正确;
B、放电时,正极反应式为I2Br-+2e-=2I-+Br-,溶液中离子数目增大,故B正确;
C、充电时,b电极反应式为Zn2++2e-=Zn,每增加0.65g,转移0.02mol电子,阳极反应式为Br-+2I--2e-=I2Br-,有0.02molI-失电子被氧化,故C正确;
D、充电时,a是阳极,应与外电源的正极相连,故D错误;
故选D。
【点睛】
本题考查化学电源新型电池,会根据电极上发生的反应判断正负极是解本题关键,会正确书写电极反应式,易错选项是B,正极反应式为I2Br-+2e-=2I-+Br-,溶液中离子数目增大。