实验室以废铜屑(含少量Fe、不溶性杂质)为原料制取CuSO4·5H2O晶体和[Cu(NH3)4]SO4·H2O晶体,其实验流程如下:


(1)氧化时先加入一定量3 mol/L H2SO4,再调节浓硝酸的用量至![]() 为2.0左右时,铜粉和浓硝酸完全反应,主要反应的化学方程式为_______。
为2.0左右时,铜粉和浓硝酸完全反应,主要反应的化学方程式为_______。
硝酸过量对产品的影响为________________________________。
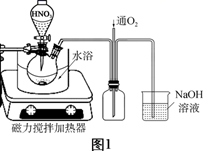
(2)废铜屑的氧化在如图1所示的装置中进行。从长导管中通入氧气的作用是___________。保持试剂的用量不变,实验中提高Cu转化率的操作有____________(写一种)。
(3)调节溶液pH应在3.5~4.5范围的原因是______________________。
(4)已知:[Cu(NH3)4]2+![]() Cu2++4NH3;CuSO4、(NH4)2SO4难溶于乙醇。结合图2,[Cu(NH3)4]SO4·H2O在乙醇水混合液中的溶解度随乙醇浓度变化曲线,补充完整由加足量氨水后所得的[Cu(NH3)4]SO4溶液制备[Cu(NH3)4]SO4·H2O晶体的实验方案:______________ (实验中必须使用的试剂和仪器:无水乙醇、乙醇-水混合液、BaCl2溶液、真空干燥箱)。
Cu2++4NH3;CuSO4、(NH4)2SO4难溶于乙醇。结合图2,[Cu(NH3)4]SO4·H2O在乙醇水混合液中的溶解度随乙醇浓度变化曲线,补充完整由加足量氨水后所得的[Cu(NH3)4]SO4溶液制备[Cu(NH3)4]SO4·H2O晶体的实验方案:______________ (实验中必须使用的试剂和仪器:无水乙醇、乙醇-水混合液、BaCl2溶液、真空干燥箱)。
答案
Cu+2HNO3+H2SO4![]() CuSO4+2NO2↑+2H2O 降低产品的产率和纯度 防止倒吸,使尾气中的氮氧化物能被完全吸收 适当提高反应温度、加快搅拌速率 使Fe3+完全水解转化为Fe(OH)3沉淀除去,而Cu2+留在溶液中 将[Cu(NH3)4]SO4溶液加入无水乙醇中,过滤,所得沉淀先用乙醇-水混合液洗涤,至最后的洗涤滤液中滴加BaCl2溶液无沉淀生成,再将晶体用无水乙醇洗涤,放入真空干燥箱中干燥
CuSO4+2NO2↑+2H2O 降低产品的产率和纯度 防止倒吸,使尾气中的氮氧化物能被完全吸收 适当提高反应温度、加快搅拌速率 使Fe3+完全水解转化为Fe(OH)3沉淀除去,而Cu2+留在溶液中 将[Cu(NH3)4]SO4溶液加入无水乙醇中,过滤,所得沉淀先用乙醇-水混合液洗涤,至最后的洗涤滤液中滴加BaCl2溶液无沉淀生成,再将晶体用无水乙醇洗涤,放入真空干燥箱中干燥
【分析】
(1)Cu与浓硝酸、硫酸发生氧化还原反应产生CuSO4、NO2和H2O,根据原子守恒、电子守恒书写反应方程式;结合物质成分分析Cu、HNO3的物质的量比例关系;
(2)从安全角度和环保角度分析通入O2的原因;根据影响反应速率的因素分析;
(3)根据Fe3+、Cu2+形成沉淀需要的溶液的pH分析;
(4)根据CuSO4、(NH4)2SO4、[Cu(NH3)4]SO4·H2O难溶于乙醇,乙溶于水,而[Cu(NH3)4]SO4·H2O在乙醇与水混合溶液中的溶解度随乙醇含量的增大而减小分析。
【详解】
(1) Cu与浓硝酸、硫酸发生氧化还原反应产生CuSO4、NO2和H2O,根据原子守恒、电子守恒书写反应方程式为Cu+2HNO3+H2SO4![]() CuSO4+2NO2↑+2H2O;在反应时为保证制取的CuSO4纯度,要严格控制HNO3的用量,尽可能使硝酸完全反应转化为NO2气体逸出,若硝酸过量,则反应后的溶液中含有过量的硝酸,则制取得到的CuSO4产品中混有Cu(NO3)2,导致产品的纯度降低,且会是CuSO4的产率也减小;
CuSO4+2NO2↑+2H2O;在反应时为保证制取的CuSO4纯度,要严格控制HNO3的用量,尽可能使硝酸完全反应转化为NO2气体逸出,若硝酸过量,则反应后的溶液中含有过量的硝酸,则制取得到的CuSO4产品中混有Cu(NO3)2,导致产品的纯度降低,且会是CuSO4的产率也减小;
(2)从长导管中通入氧气,可以防止因NO2在NaOH溶液中的溶解而产生的装置内气体压强减小,从而引起倒吸现象的发生;且能使反应产生的NO反应变为NO2,再被NaOH溶液完全吸收,就避免了氮氧化合物对大气造成的污染;
Cu是固体物质,在保持试剂的用量不变,在实验中若要提高Cu转化率,可通过适当提高反应温度、加快搅拌速率使反应物充分接触实现;
(3)在废铜屑中含少量Fe,在用浓硝酸与硫酸混合液氧化Cu时,Fe被氧化变为Fe3+,由于Fe3+形成Fe(OH)3沉淀,沉淀完全时溶液的pH=3.2,调节溶液pH应在3.5~4.5范围,就可以使Fe3+完全转化为Fe(OH)3沉淀除去,而Cu2+仍留在溶液中,以保证制取得到纯净的CuSO4;
(4)将制得的[Cu(NH3)4]SO4溶液加入无水乙醇中,由图象可知[Cu(NH3)4]SO4·H2O在无水乙醇中不能溶解,就会析出[Cu(NH3)4]SO4·H2O沉淀,然后过滤得到[Cu(NH3)4]SO4·H2O沉淀,所得沉淀中混有杂质CuSO4、(NH4)2SO4,先用乙醇-水混合液洗涤,除去杂质,然后根据BaSO4是白色不溶于水的沉淀,通过检验洗涤液中是否含有SO42-,来判断沉淀是否洗涤干净,向最后的洗涤滤液中滴加BaCl2溶液无沉淀生成,说明沉淀洗涤干净,最后再将晶体用无水乙醇洗涤,放入真空干燥箱中干燥,就得到[Cu(NH3)4]SO4·H2O。
【点睛】
本题考查了物质的制备方法、反应条件的控制、环境保护及物质分离提纯等。掌握反应原理,根据物质的溶解性、氧化性等分析解答。

 (实验室制CO2气体时,若无稀盐酸可用稀硝酸代替)
(实验室制CO2气体时,若无稀盐酸可用稀硝酸代替)



 等,应注意的是NO3-无氧化性,而当NO3-在酸性溶液中时,则具有强氧化性。例如,在Fe(NO3)2溶液中加入盐酸或硫酸,因引入了H+而使Fe2+被氧化为Fe3+;又如,向浓HNO3与足量的Cu反应后形成的Cu(NO3)2中再加入盐酸或硫酸,则剩余的Cu会与后来新形成的稀HNO3继续反应。 F. 能氧化并腐蚀某些有机物,如皮肤、衣服、纸张、橡胶等。因此在使用硝酸(尤其是浓硝酸)时要特别小心,万一不慎将浓硝酸弄到皮肤上,应立即用大量水冲洗,再用小苏打或肥皂液洗涤。
等,应注意的是NO3-无氧化性,而当NO3-在酸性溶液中时,则具有强氧化性。例如,在Fe(NO3)2溶液中加入盐酸或硫酸,因引入了H+而使Fe2+被氧化为Fe3+;又如,向浓HNO3与足量的Cu反应后形成的Cu(NO3)2中再加入盐酸或硫酸,则剩余的Cu会与后来新形成的稀HNO3继续反应。 F. 能氧化并腐蚀某些有机物,如皮肤、衣服、纸张、橡胶等。因此在使用硝酸(尤其是浓硝酸)时要特别小心,万一不慎将浓硝酸弄到皮肤上,应立即用大量水冲洗,再用小苏打或肥皂液洗涤。 


 等,这取决于硝酸的浓度和还原剂还原性的强弱。除前面的实例外,锌与硝酸可发生如下反应:
等,这取决于硝酸的浓度和还原剂还原性的强弱。除前面的实例外,锌与硝酸可发生如下反应:
