下列实验操作能达到实验目的的是( )
A.可用干燥的pH试纸测量氯水的pH
B.蒸干FeCl3溶液制无水FeCl3固体
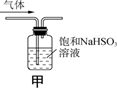
C.用装置甲除去SO2中的少量HCl
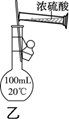
D.用装置乙配制100 mL 0.50 mol·L-1硫酸溶液
答案
C
【详解】
A. 氯水具有强的氧化性,会漂白试纸,因此不能使用pH试纸测定氯水的pH,A错误;
B. FeCl3是强酸弱碱盐,在溶液中Fe3+会发生水解反应产生Fe(OH)3,所以制无水FeCl3固体要在HCl气氛中加热,不能直接蒸干FeCl3溶液来制取,B错误;
C. SO2与饱和NaHSO3溶液不能反应,而HCl与NaHSO3会发生反应产生SO2,因此可用甲装置除去SO2中的少量HCl,C正确;
D. 用浓硫酸配制100 mL 0.50 mol·L-1硫酸溶液时,应该先在烧杯中进行稀释,冷却至室温后,将溶液转移至100 mL的容量瓶中,D错误;
故合理选项是C。

