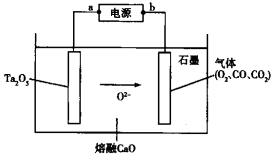
常温下,2NH3(g)+NaClO(aq)=NaCl(aq)+N2H4(aq)+H2O(l)能自发进行,可用于生产N2H4。下列有关说法正确的是
A.该反应的△H>0,△S<0
B.每生成1mol N2H4转移2mol电子
C.室温下,向0.lmol/L NaClO溶液中加水,溶液pH增大
D.N2H4、O2和KOH溶液组成的燃料电池,负极反应为![]()
答案
B
【详解】
A. 常温下能自发进行,则△H-T△S<0,由化学方程式可知△S<0,则△H<0,故A错误;
B. N元素化合价由-3价升高为-2价,转移1个电子,则每生成1mol N2H4转移2mol电子,故B正确;
C. NaClO溶液水解呈碱性,加水稀释,溶液pH减小,故C错误;
D. N2H4、O2和KOH溶液组成的燃料电池,负极反应为![]() ,故D错误;
,故D错误;
故答案选:B。