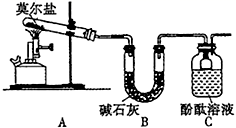
已知硫酸亚铁铵[(NH4)2SO4·FeSO4·6H2O]俗称莫尔盐,其摩尔质量为392 g/mol,可溶于水,在100℃~ 110 ℃时分解。为探究其化学组成,甲乙两同学设计了如下实验。
Ⅰ.探究莫尔盐晶体加热时的分解产物。
(1)甲同学设计如下图所示的装置进行实验,装置C中可观察到的现象是溶液变红,由此可知分解产物中有_____________。
(2)乙同学认为莫尔盐晶体分解的产物中还含有SO3(g)、SO2(g)及N2(g)。为验证产物的存在,用下列装置进行实验:
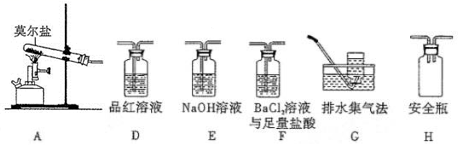
①乙组同学的实验中,装置依次连接的合理顺序为A→H→__________________________→G
②证明含有SO3的实验现象是_______________。
II.为测硫酸亚铁铵纯度,称取m g 莫尔盐样品,配成500 mL溶液。甲、乙两同学设计了如下两个实验方案。
甲方案:取25.00mL硫酸亚铁铵溶液用0.1000mol•L-1的酸性K2Cr2O7溶液分三次进行滴定。
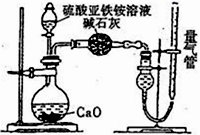
乙方案:(通过NH4+测定)设计装置如下图所示。取25.00 mL样品溶液进行该实验。
(1)滴定过程中,酸性K2Cr2O7溶液应装在_____________滴定管中。甲方案中的离子方程式为_________________________________。
(2)乙方案中量气管中最佳试剂是______(填字母)。
a.水 b.饱和NaHCO3溶液 c.CC14
(3)乙方案中收集完气体并恢复至室温,读数前应进行的操作是______________________________。
(4)若测得NH3(已折算为标准状况下)为VL,则硫酸亚铁铵纯度为___________。(用含V、m的式子表示)
答案
NH3 F→D→E F中出现白色沉淀 酸式 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O c 上下移动量气管(滴定管),使左右两边液面相平 ![]() ×100%或
×100%或![]() 100%
100%
【分析】
探究莫尔盐晶体加热时的分解产物的实验中,根据酚酞溶液变红可确定有氨气生成;其他几种产物的检验应科学合理,由于三氧化硫能与水剧烈反应生成硫酸,故应先检验三氧化硫,可选择F装置;然后检验二氧化硫,选择D装置;接着通入E装置,将可能剩余的二氧化硫完全吸收;最后用排水集气法收集剩余的气体,以确定有氮气。测硫酸亚铁铵纯度的实验,可以根据其中亚铁离子的还原性进行氧化还原滴定的实验,也可以根据铵盐可以与碱在加热条件下生成氨气,测定氨气的体积。
【详解】
I.(1)装置B中的碱石灰吸收分解产生的酸性气体,装置C中酚酞溶液变红,根据莫尔盐的组成,则莫尔盐受热的分解产物中有NH3。
(2)乙同学认为莫尔盐晶体分解的产物中还含有SO3(g)、SO2(g)及N2(g),用BaCl2与足量盐酸的混合液检验SO3(g),用品红溶液检验SO2(g),N2难溶于水用排水法收集;由于SO3能被水溶液吸收,所以先检验SO3(g),再检验SO2(g),用NaOH溶液除去SO2,最后用排水法收集N2;装置的合理连接顺序为A→H→F→D→E→G。
①根据上述分析,装置的合理连接顺序为A→H→F→D→E→G。
②证明含有SO3的实验现象是:装置F中出现白色沉淀。
II.(1)酸性K2Cr2O7溶液具有强氧化性,应装在酸式滴定管中。Cr2O72-将Fe2+氧化成Fe3+,自身被还原成Cr3+,1molCr2O72-参与反应得到6mol电子,1molFe2+参与反应失去1mol电子,根据得失电子守恒、原子守恒和电荷守恒,甲方案中的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。
(2)根据乙方案的装置,硫酸亚铁铵溶液与CaO反应产生NH3,用碱石灰除去NH3中的H2O(g),用量气法量取NH3的体积。a项,由于NH3极易溶于水,水能吸收NH3;b项,由于NH3极易溶于水且其水溶液呈碱性,饱和NaHCO3溶液吸收NH3;c项,NH3难溶于CCl4,不吸收NH3;量气管中最佳试剂为CCl4,答案选c。
(3)用量气体的体积进行定量实验时,还需要测量温度和压强,所以实验结束要恢复到室温,使气体产生的压强等于大气压。乙方案中收集完气体并恢复至室温,读数前应进行的操作是:上下移动量气管(滴定管),使左右两边液面相平。
(4)根据N守恒,25.00mL样品中n[(NH4)2SO4·FeSO4·6H2O]=![]() n(NH3)=
n(NH3)=![]() mol,500mL溶液中n[(NH4)2SO4·FeSO4·6H2O]=
mol,500mL溶液中n[(NH4)2SO4·FeSO4·6H2O]=![]() mol
mol![]() =
=![]() mol,m[(NH4)2SO4·FeSO4·6H2O]=
mol,m[(NH4)2SO4·FeSO4·6H2O]=![]() mol
mol![]() 392g/mol=
392g/mol=![]() g,则硫酸亚铁铵纯度为
g,则硫酸亚铁铵纯度为![]() 100%=
100%=![]() 100%。
100%。


 2SO3
2SO3





 无色溶液
无色溶液 恢复原色。
恢复原色。


 ,如下数轴所示:
,如下数轴所示:
 则固体物质为Na2SO3,
则固体物质为Na2SO3, ,则固体物质为NaOH 和Na2SO3.
,则固体物质为NaOH 和Na2SO3. ,则同体物质为NaHSO3
,则同体物质为NaHSO3 ,则固体物质为Na2SO3和NaHSO3,
,则固体物质为Na2SO3和NaHSO3, ,则固体物质为NaHSO3。
,则固体物质为NaHSO3。