某固体混合物 X 可能是由 Na2SiO3、 Fe 、 Na2CO3、 BaCl2中的两种或两种以上的物质组成。某兴趣小组为探究该固体混合物的组成,设计实验方案如下图所示(所加试剂均过量)。下列说法不正确的是:
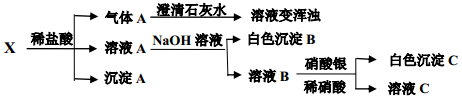
A.该固体混合物一定含有 Fe、 Na2CO3、 BaCl2
B.气体A一定是混合气体
C.白色沉淀B在空气中逐渐变灰绿色,最后变红褐色
D.沉淀A一定是 H2SiO3
答案
A
【解析】由实验可知,A与澄清石灰水变浑浊,则A一定含有CO2,混合物与足量盐酸反应有沉淀A生成,沉淀A是H2SiO3,溶液A与NaOH反应后生成白色沉淀B,则B是Fe(OH)2,溶液B与稀硝酸、硝酸银反应生成沉淀C是氯化银,则原混合物中一定有Na2SiO3、 Fe 、 Na2CO3,可能有BaCl2。A、原混合物中一定有Na2SiO3、 Fe 、 Na2CO3,可能有BaCl2,故A错误;B、气体A是二氧化碳和氢气的混合气体,故B正确;C、白色沉淀Fe(OH)2在空气中逐渐变灰绿色,最后变红褐色,故C正确;D、沉淀A一定是 H2SiO3,故D正确;故选A。


 的检验:
的检验: ,
, 具有不溶于盐酸、硝酸的特性。
具有不溶于盐酸、硝酸的特性。 溶液或
溶液或 溶液,盐酸和稀硝酸。
溶液,盐酸和稀硝酸。  、
、 等判成SO42-,此时上述离子会分别产生
等判成SO42-,此时上述离子会分别产生 等白色沉淀.
等白色沉淀. 等判成SO42-,如向待测液中先滴加
等判成SO42-,如向待测液中先滴加 溶液,再加盐酸有白色沉淀生成便断定含SO42-。其错误之处是未注意溶液中不含SO42-而含Ag+或
溶液,再加盐酸有白色沉淀生成便断定含SO42-。其错误之处是未注意溶液中不含SO42-而含Ag+或 也会有同样现象,因为
也会有同样现象,因为

 判成
判成 ,如向待测液中滴加盐酸酸化的
,如向待测液中滴加盐酸酸化的 溶液,或滴加硝酸酸化的
溶液,或滴加硝酸酸化的 ,错在未注意
,错在未注意 在酸性条件下具有强氧化性,可将
在酸性条件下具有强氧化性,可将
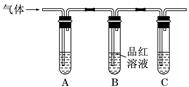
 的检验常用气体法:
的检验常用气体法: (不能用硝酸等强氧化性酸),生成能使品红溶液褪色的无色有刺激性气味的气体。
(不能用硝酸等强氧化性酸),生成能使品红溶液褪色的无色有刺激性气味的气体。  的检验
的检验  ,所用酸必须是非强氧化性酸,可用稀盐酸或稀硫酸,生成能使湿润的醋酸铅试纸变黑的气体。
,所用酸必须是非强氧化性酸,可用稀盐酸或稀硫酸,生成能使湿润的醋酸铅试纸变黑的气体。  ,生成黑色沉淀;或
,生成黑色沉淀;或 ,生成乳白色或黄色沉淀(溶液中)。
,生成乳白色或黄色沉淀(溶液中)。 ”表示。
”表示。 





 。
。 。
。  等亚硫酸盐易溶于水、易电离。
等亚硫酸盐易溶于水、易电离。