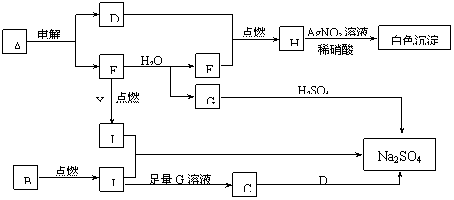
绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,溶液逐渐变红。由此可知:______________、_______________。
(2)为测定绿矾中结晶水含量,将石英玻璃管(带两端开关K1和K2)(设为装置A)称重,记为m1 g。将样品装入石英玻璃管中,再次将装置A称重,记为 m2 g。按下图连接好装置进行实验。
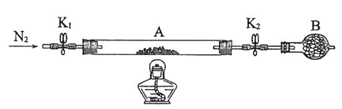
①仪器B的名称是____________________。
②将下列实验操作步骤正确排序___________________(填标号);重复上述操作步骤,直至A恒重,记为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K1和K2
d.打开K1和K2,缓缓通入N2 e.称量A f.冷却到室温
③根据实验记录,计算绿矾化学式中结晶水数目x=________________(列式表示)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入下图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。
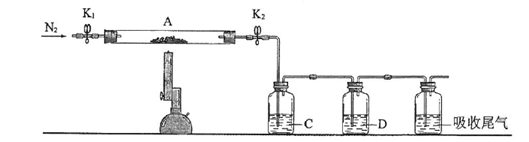
①C、D中的溶液依次为______(填标号)。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
②C、D中有气泡冒出,并可观察到的现象分别为_________________________。
答案
样品中没有Fe3+Fe2+易被氧气氧化为Fe3+①干燥管② dabfce③![]() ①c、a②生成白色沉淀、褪色
①c、a②生成白色沉淀、褪色
【解析】
(1)溶液中先滴加KSCN溶液,溶液颜色无明显变化,说明绿矾样品中无Fe3+,硫酸亚铁与KSCN不反应;再向试管中通入空气,溶液逐渐变红,则溶液中有Fe3+生成,说明硫酸亚铁易被空气氧化为硫酸铁,Fe3+与KSCN反应,使溶液变红。
(2)①仪器B中装有固体干燥剂,所以B的名称为干燥管。
②装置应先通入N2,排净装置中的空气,再点燃酒精灯,开始反应,反应结束后先熄灭酒精灯,使装置冷却到室温后,再关闭K1和K2,进行称量。所以操作步骤顺序为dabfce。
③结晶水的数目为x,则存在![]() ,故解得
,故解得![]() ;
;
(3)①C中溶液为BaCl2,目的是吸收生成的SO3,D中溶液为品红溶液,检验SO2;②C、D中均有气泡冒出,则C中溶液为BaCl2,吸收生成的SO3,有白色沉淀生成,而SO2气体不反应,D中溶液为品红溶液,遇到SO2气体会褪色。


 2SO3
2SO3





 无色溶液
无色溶液 恢复原色。
恢复原色。


 ,如下数轴所示:
,如下数轴所示:
 则固体物质为Na2SO3,
则固体物质为Na2SO3, ,则固体物质为NaOH 和Na2SO3.
,则固体物质为NaOH 和Na2SO3. ,则同体物质为NaHSO3
,则同体物质为NaHSO3 ,则固体物质为Na2SO3和NaHSO3,
,则固体物质为Na2SO3和NaHSO3, ,则固体物质为NaHSO3。
,则固体物质为NaHSO3。