近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如图:
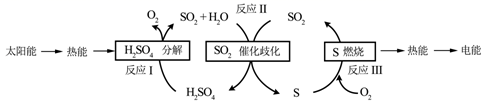
(1)反应Ⅰ:2H2SO4(l)=2SO2(g)+2H2O(g)+O2(g)ΔH1=+551kJ·mol-1
反应Ⅲ:S(s)+O2(g)=SO2(g)ΔH3=-297kJ·mol-1
反应Ⅱ的化学方程式为___,标准状况下每有6.72L的SO2发生反应,释放的能量为___kJ。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。
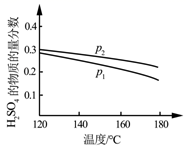
p2___p1(填“>”或“<”),得出该结论的理由是___。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下:
i.SO2+4H++4I-=S↓+2I2+2H2O
ii.I2+2H2O+SO2=4H++4I-+SO![]()
探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18mLSO2饱和溶液加入到2mL下列试剂中,密闭放置观察现象。
| 序号 | A | B | C |
| 试剂组成 | 0.4mol·L-1KI | 0.2mol·L-1H2SO4 | amol·L-1KI,0.2mol·L-1 H2SO4 |
| 实验现象 | 溶液变黄,一段时间后出现浑浊 | 无明显现象 | 溶液变黄,出现浑浊较A快 |
①C是A的对比实验,则a=___。
②设计实验B、C的目的:___。
答案
3SO2+2H2O=2H2SO4+S 25.4kJ > 反应Ⅱ是气体物质的量减小的反应,温度一定时,增大压强使反应正向移动,H2SO4的物质的量增大,体系总物质的量减小,H2SO4的物质的量分数增大 0.4 H+单独存在时不具有催化作用,但H+可以加快歧化反应速率
【分析】
(1)根据图式书写反应Ⅱ的方程式;根据盖斯定律计算出反应Ⅱ的焓变再计算。
(2) 反应Ⅱ是气体物质的量减小的反应,根据相同温度下,压强对平衡的影响,结合图像分析解答;
(3)①C是A的对比实验,所用c(KI)应该相等;②比较A、B、C,A中只含KI、B中只含硫酸、C中含有KI和硫酸,反应快慢顺序是C>A>B,且B中没有明显现象,说明未发生反应,C中含有酸导致其反应速率加快,据此分析解答。
【详解】
(1)根据图示,反应Ⅱ为3SO2(g)+2H2O(g)=2H2SO4(l)+S(s);将I-Ⅲ得3SO2(g)+2H2O(g)=2H2SO4(l)+S(s),△H=-(+551kJ•mol-1)-(-297kJ•mol-1)=-254kJ/mol,标准状况下6.72L的SO2的物质的量为![]() =0.3mol,因此0.3mol发生反应释放的能量为
=0.3mol,因此0.3mol发生反应释放的能量为![]() ×254kJ/mol=25.4kJ,故答案为:3SO2+2H2O=2H2SO4+S ;25.4kJ;
×254kJ/mol=25.4kJ,故答案为:3SO2+2H2O=2H2SO4+S ;25.4kJ;
(2)相同温度下,增大压强,3SO2+2H2O⇌2H2SO4+S平衡正向移动,导致硫酸在平衡体系中物质的量分数增大,根据图知,相同温度下,达到平衡状态时硫酸含量:p1<p2,说明压强p2>p1,故答案为:>;反应Ⅱ是气体物质的量减小的反应,温度一定时,增大压强使反应正向移动,H2SO4的物质的量增大,体系总物质的量减小,H2SO4的物质的量分数增大;
(3)①C是A的对比实验,所用c(KI)应该相等,否则无法得出正确结论,所以a=0.4,故答案为:0.4;
②比较A、B、C,A中只含KI、B中只含硫酸、C中含有KI和硫酸,反应快慢顺序是C>A>B,且B中没有明显现象,说明未发生反应,C中含有酸导致其反应速率加快,因此设计实验B、C的目的是H+单独存在时不具有催化作用,但H+可以加快歧化反应速率,故答案为:H+单独存在时不具有催化作用,但H+可以加快歧化反应速率。
【点睛】
本题的易错点和难点为(3),要注意作对比实验时应该只有一个条件不同,其它条件需要完全相同。

 pC(g)+qD(g)
pC(g)+qD(g)  。
。 时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。
时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。 指的是同一物质的正反应速率与逆反应速率相等。
指的是同一物质的正反应速率与逆反应速率相等。  qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。
qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。