根据下列图示所得出的结论正确的是

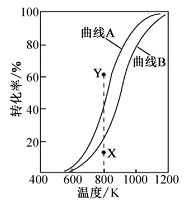
A.图甲表示H2S(g)受热分解时各组分体积分数随反应温度的变化关系,说明反应生成H2和S(g)
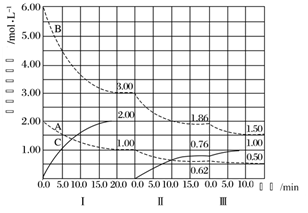
B.图乙表示恒容密闭容器中其它条件相同时改变温度,反应CO2(g)+3H2(g)⇌CH3OH(g)+H2O(g)中n(CH3OH)随时间的变化曲线,说明反应平衡常数KⅠ<KⅡ
C.图丙表示10mL0.01mol·L-1酸性KMnO4溶液与过量的0.1mol·L-1H2C2O4溶液混合时n(Mn2+)随时间的变化,说明Mn2+对该反应可能有催化作用
D.图丁表示炭黑作用下O2生成活化氧过程中能量变化情况,说明每活化一个氧分子吸收0.29eV的能量
答案
C
【详解】
A.若H2S(g)受热分解发生反应H2S(g)![]() H2(g)+S,若硫单质是气态,则H2(g)和S(g)的体积分数应该相等,若硫单质是非气态,它的体积分数应为零,由图象说明生成物不是H2和S(g),A错误;
H2(g)+S,若硫单质是气态,则H2(g)和S(g)的体积分数应该相等,若硫单质是非气态,它的体积分数应为零,由图象说明生成物不是H2和S(g),A错误;
B.由图可知,曲线II先达到平衡,对应的温度高,升高温度平衡向n(CH3OH)减少的方向即逆反应方向移动,所以反应平衡常数KⅠ>KⅡ,B错误;
C.酸性KMnO4溶液与H2C2O4溶液反应生成Mn2+,则n(Mn2+)随时间的变化而增大,由图可知反应速率随反应的进行大大加快,说明Mn2+对该反应可能有催化作用,C正确;
D.根据能量变化图分析,最终结果为活性氧,体系能量降低,则每活化1mol氧分子放出0.29eV的能量,D错误。
答案选C。

 pC(g)+qD(g)
pC(g)+qD(g)  。
。 时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。
时,平衡便会发生移动而使各组分的浓度、百分含量发生变化,直至建立新的平衡。 指的是同一物质的正反应速率与逆反应速率相等。
指的是同一物质的正反应速率与逆反应速率相等。  qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。
qD(g),根据对化学平衡概念的理解,判断下列各情况是否达到平衡。