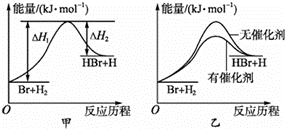
反应M+Z→Q(ΔH>0)分两步进行:①M+Z→X(ΔH<0),②X→Q(ΔH>0)。下列示意图中,能正确表示总反应过程中能量变化的是( )
A. B.
B.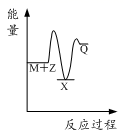
C. D.
D.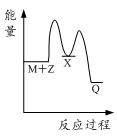
答案
B
【分析】
根据物质具有的能量进行计算:△H=E(生成物的总能量)-E(反应物的总能量),当反应物的总能量大于生成物的总能量时,反应放热,当反应物的总能量小于生成物的总能量时,反应吸热,以此解答该题。
【详解】
由反应 M+Z→Q(△H>0)分两步进行 ①M+Z→X (△H<0)②X→Q(△H>0)可以看出:
(1)M+Z→Q(△H>0)是吸热反应,M和Z的能量之和小于Q,
(2)由①M+Z→X(△H<0)可知这步反应是放热反应,则M和Z的能量之和大于X,
(3)由②X→Q(△H>0)是吸热反应,故X的能量小于Q;
综上可知,X的能量小于M+Z;M+Z的能量小于Q,只有图象B符合。
答案选B。