某NaOH固体中含有Na2CO3杂质。老师安排第一小组同学除去NaOH中的Na2CO3;第二小组同学测定固体混合物中的Na2CO3的质量分数。
Ⅰ.第一小组同学取一定量固体溶于水,得到混合溶液,为了除去溶液中的Na2CO3杂质,甲、乙、丙、丁四位同学分别选择下列试剂进行实验,其中合理的是________。
甲:适量稀盐酸
乙:过量KOH溶液
丙:适量Ba(OH)2溶液
丁:适量CaCl2溶液
Ⅱ.第二组同学测定NaOH和Na2CO3混合物(质量为a g)中Na2CO3的质量分数的操作流程如下:
![]()
![]() 溶液
溶液 ![]() CaCO3
CaCO3![]() 质量为c g
质量为c g
(1)如果A是两种元素组成的盐,则A是________(填化学式)。
(2)B操作的名称是________,该操作中用到的玻璃仪器是________。实验要求加入的A溶液必须过量,以保证反应物完全进行。检查原溶液中被反应对象已经反应完的方法是_____。
(3)实验中洗涤碳酸钙沉淀的方法是________。检验沉淀已经洗涤干净的方法是___________。
(4)混合物中Na2CO3的质量分数为______________用a、c的代数式表示)。
答案
丙 CaCl2 过滤 漏斗、玻璃棒、烧杯 向上层清液中继续滴加CaCl2溶液,如无沉淀产生,则原溶液中Na2CO3已经反应完 沿玻璃棒向过滤器滤纸上的沉淀引流蒸馏水,至沉淀物刚好被浸没,待水滤出后再重复2~3次 取最后一次洗涤液少许于试管中,滴加AgNO3溶液,若不出现浑浊,则已洗涤干净 ![]() %
%
【解析】
Ⅰ.根据除杂的原则分析判断;
Ⅱ. (1)加入A溶液的目的是使碳酸钠转化为碳酸钙沉淀,据此分析判断;
(2)B操作是从溶液中分离出碳酸钙沉淀,据此分析解答;检查碳酸钠反应完可以检查溶液中没有了碳酸钠,据此分析解答;
(3)根据洗涤沉淀的一般方法解答。碳酸钙沉淀上吸附有氢氧化钠和氯化钠,检验沉淀洗涤干净可以检验氯离子,据此分析解答;
(4) 根据Na2CO3+ CaCl2= CaCO3↓+ 2NaCl分析计算。
【详解】
Ⅰ. 甲.适量稀盐酸与氢氧化钠和碳酸钠均能反应,将氢氧化钠也除去了,故错误;乙.过量KOH溶液与氢氧化钠和碳酸钠均不能发生复分解反应,故错误;丙.适量Ba(OH)2溶液与碳酸钠反应生成碳酸钡沉淀和氢氧化钠,能够达到除去NaOH固体中含有Na2CO3杂质的目的,故正确;丁.适量CaCl2溶液与碳酸钠反应生成了碳酸钙沉淀和氯化钠,引入了新杂质,故错误;故答案为丙;
Ⅱ. (1)加入A溶液的目的是使碳酸钠转化为碳酸钙沉淀,如果A是两种元素组成的盐,则A是氯化钙,故答案为CaCl2;
(2)B操作是从溶液中分离出碳酸钙沉淀,故B操作为过滤;过滤操作中用到的玻璃仪器有漏斗、玻璃棒、烧杯;实验要求加入的A溶液必须过量,以保证反应物完全进行。检查碳酸钠反应完的方法是向上层清液中继续滴加CaCl2溶液,如无沉淀产生,则原溶液中Na2CO3已经反应完,故答案为过滤;漏斗、玻璃棒、烧杯;向上层清液中继续滴加CaCl2溶液,如无沉淀产生,则原溶液中Na2CO3已经反应完;
(3)洗涤碳酸钙沉淀的方法为沿玻璃棒向过滤器滤纸上的沉淀引流蒸馏水,至沉淀物刚好被浸没,待水滤出后再重复2~3次。碳酸钙沉淀上吸附有氢氧化钠和氯化钠,检验沉淀洗涤干净可以检验氯离子,方法为取最后一次洗涤液少许于试管中,滴加AgNO3溶液,若不出现浑浊,则已洗涤干净,故答案为沿玻璃棒向过滤器滤纸上的沉淀引流蒸馏水,至沉淀物刚好被浸没,待水滤出后再重复2~3次;取最后一次洗涤液少许于试管中,滴加AgNO3溶液,若不出现浑浊,则已洗涤干净;
(4) Na2CO3+ CaCl2= CaCO3↓+ 2NaCl
106 100
m(Na2CO3) c g
![]() =
=![]() ,解得:m(Na2CO3)=
,解得:m(Na2CO3)= ![]() cg,混合物中Na2CO3的质量分数=
cg,混合物中Na2CO3的质量分数=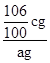 ×100%=
×100%=![]() %,故答案为
%,故答案为![]() %。
%。


