8.34 g FeSO4·7H2O(相对分子质量:278)样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示,下列说法正确的是
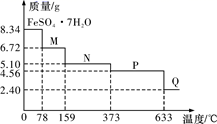
A.温度为78 ℃时固体物质M的化学式为FeSO4·5H2O
B.取适量380 ℃时所得的样品P,隔绝空气加热至650 ℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe3O4
C.在隔绝空气条件下,N得到P的化学方程式为FeSO4·H2O![]() FeSO4+H2O
FeSO4+H2O
D.温度为159 ℃时固体N的化学式为FeSO4·2H2O
答案
C
【解析】
8.34 g FeSO4·7H2O 样品的物质的量为8.34 g÷278 g/mol=0.03 mol,其中m(H2O)=0.03 mol×7×18 g/mol=3.78 g,如晶体失去全部结晶水,固体的质量应为8.34 g-3.78 g=4.56 g,可知在加热到373℃之前,晶体失去部分结晶水,据此回答。
【详解】
A.温度为78 ℃时,固体质量为6.72 g,其中m(FeSO4)=0.03 mol×152 g/mol=4.56 g,m(H2O)=6.72 g-4.56 g=2.16 g,n(H2O)=2.16 g÷18 g/mol=0.12 mol,则n(H2O)∶n(FeSO4)=0.12 mol∶0.03 mol=4∶1,则化学式为FeSO4·4H2O,A项错误;
B.加热至650 ℃时,固体的质量为2.40 g,其中n(Fe)=n(FeSO4·7H2O)=0.03 mol,m(Fe)=0.03 mol×56 g/mol=1.68 g,则固体中m(O)=2.40 g-1.68 g=0.72 g,n(O)=0.72 g÷16 g/mol=0.045 mol,则n(Fe)∶n(O)=0.03 mol∶0.045 mol=2∶3,则固体物质Q的化学式为Fe2O3,B项错误;
C.固体N的质量为5.10 g,其中m(FeSO4)=0.03 mol×152 g/mol=4.56 g,m(H2O)=5.10 g-4.56 g=0.54 g,n(H2O)=0.54 g÷18 g/mol=0.03 mol,则n(H2O)∶n(FeSO4)=0.03 mol∶0.03 mol=1∶1,则N的化学式为FeSO4·H2O,P的化学式为FeSO4,则在隔绝空气条件下由N得到P的化学方程式为FeSO4·H2O![]() FeSO4+H2O,C项正确;
FeSO4+H2O,C项正确;
D.温度为159℃时,由C项可知N的化学式为FeSO4·H2O,D项错误。
故选C。



 N2+3Cu+3H2O
N2+3Cu+3H2O

